_p0_Cover.jpg)
_p1_Titul_min.png)
_p1_Titul_min.png)

_p0_cover.jpg)
_p0_Cover.jpg)
_p2_RedColl_min.jpg)

_p0_cover.jpg)
_p4_Content_min.jpg)
_p0_Cover.jpg)
Категория: Руководства
1 Биофармацевтические исследования in vivo и in vitro в разработке воспроизведенных ЛС: оценка причин возможной неэквивалентности препаратов сентября 2014 г Шохин И.Е. к.фарм.н, зав. отделом разработки ЛС НИИ Фармации, гл. ред. научно-производственного журнала «Разработка и регистрация лекарственных средств», ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации 3-й международный аналитический симпозиум "Аналитическая оценка активных фармацевтических субстанций и лекарственных препаратов: от молекулы до готового продукта" 
2 15 апреля 2014 г Список Стратегически значимых ЛС ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации утвержден Распоряжением Правительства Российской Федерации от 6 июля 2010 г. N 1141-р 57 лекарственных средств химико-фармацевтические и биотехнологические препараты для лечения социально значимых заболеваний производство должно быть налажено к 2014 г 
3 15 апреля 2014 г Руководство по экспертизе лекарственных средств ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации Руководство по экспертизе лекарственных средств. Том I. М. Гриф и К, с. Рекомендовано ученым советом ФГБУ «НЦ ЭСМП» Минздрава России 20 декабря 2012 г Начало официальной продажи издания – апрель 2013 г Основной рекомендательный документ по экспертизе ЛС в России 
4 15 апреля 2014 г Руководство по экспертизе лекарственных средств ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации Глава 7 «Изучение биоэквивалентности воспроизведенных лекарственных средств» Рекомендации по проведению биоэквивалентности сходны с таковыми, предъявляемые действующим Руководством ЕМА Впервые в России в официальном документе, регламентирующем исследования БЭ, появился термин «валидация» 
5 15 апреля 2014 г Руководство по экспертизе лекарственных средств ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации Впервые в России в официальном документе Минздрава регламентируется проведение ТСКР в нескольких средах растворения 3 среды растворения (1,2, 4,5, 6,8) + среда растворения согласно НД на препарат Фактически, объединены требования ЕМА к проведению ТСКР и Методических указаний 2008 г 
6 15 апреля 2014 г Руководство по экспертизе лекарственных средств ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации Исследуется 12 единиц лекарственных средств вместо 6 – более достоверные результаты для высоковариабельных препаратов (клопидогрель и т.д.) Объем работ лаборатории при проведении ТСКР по новым требованиям возрастает в 6 (если среда согласно НД совпадает с одной из трех сред) или 8 раз (если среда не совпадает) 
7 15 апреля 2014 г Биофармацевтические исследования на стадии разработки ЛС ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации Фармацевтическая разработка дженериков в твердых дозированных ЛФ должна включать в себя: оценка класса АФС по БКС разработка методики для теста «Растворение» по принципам QbD детальное изучения профиля растворения в различных средах предиктивное/био релевантное растворение PBPK-моделирование … 
8 15 апреля 2014 г Биофармацевтические исследования на стадии разработки ЛС ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации В то же время, иногда среди биофармацевтических исследований на стадии разработки дженериков в твердых ЛФ включены только: разработка методики для теста «Растворение» основана преимущественно на методике для оригинального ЛС изучение профиля растворения проводится формально, в среде контроля качества не проводится предиктивное/био релевантное растворение/PBPK-моделирование … 
9 15 апреля 2014 г Современные биофармацевтические исследования НИИ Фармации ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации Пример 1: Выполнение НИР с использованием методов in vitro и in vivo на стадии разработки ЛС Пример 2: исследование сравнительной кинетики растворения двухкомпонентного ЛС с последующим определением методом UPLC (трансфер методики HPLC – UPLC) 
10 15 апреля 2014 г Современные биофармацевтические исследования НИИ Фармации ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации Никакая конфиденциальная информация (фирмы- производители ЛС, торговые название препаратов, МНН) не приводится в примерах данной презентации 
11 15 апреля 2014 г Пример 1 ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации разработан препарат-дженерик, ЛФ – суппозитории АФС – НПВС, 2 класс БКС, включен в Перечень ЖПВЛП соответствует нормам НД, но в НД (согласно действующим требованиям) отсутствует показатель «Растворение» пилотное перекрестное исследование БЭ аналитический метод – ВЭЖХ-УФ (Agilent 1290, ПКО 40 нг/мл) 
12 15 апреля 2014 г ВЭЖХ Agilent Infinity 1290 ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации 
13 15 апреля 2014 г Типичная хроматограмма, 800 нг/мл ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации 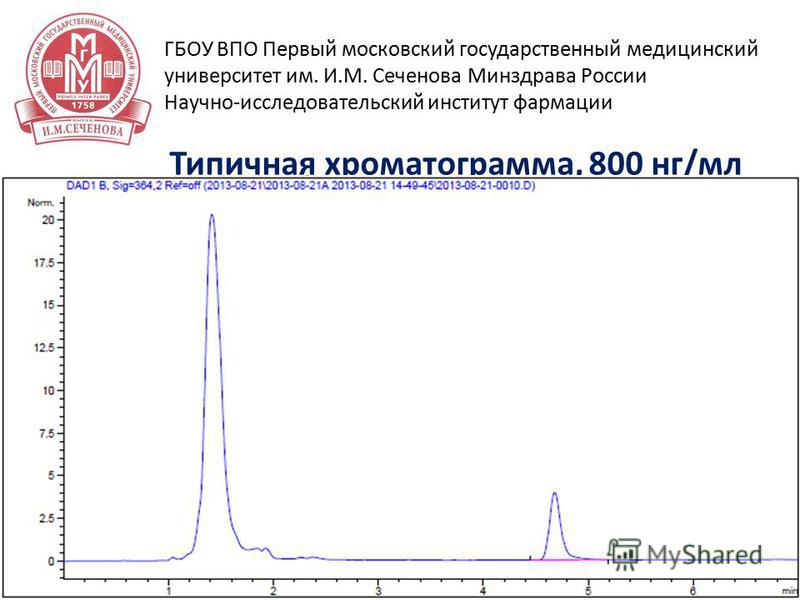
14 15 апреля 2014 г ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации результаты исследования – препараты неэквивалентны по основным фармакокинетическим параметрам (С max и AUC), различия в средних значениях данных параметров для препарата сравнения выше в 2 раза Пример 1 
15 15 апреля 2014 г ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации препараты неэквивалентны по C max, AUC 0-t, и C max / AUC 0-t 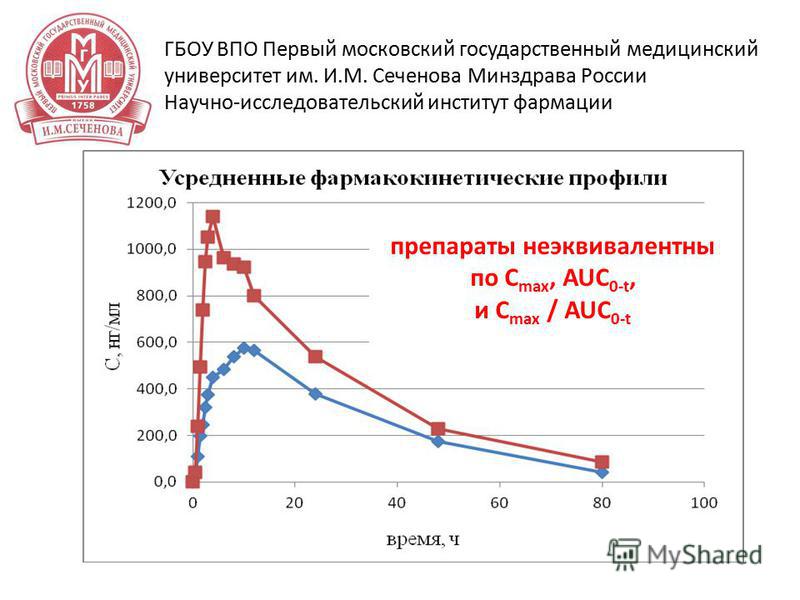
16 15 апреля 2014 г Корректирующие действия ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации ТСКР для исследуемых препаратов (ERWEKA DT 700) «суппозиторная корзинка», 80 об/мин среда растворения – фосфатный буферный раствор pH 7,5, 500 мл (моделируется rectum). временные точки отбора проб: 5 мин, 15 мин, 30 мин, 45 мин, 60 мин, 75 мин, 90 мин, 105 мин, 120 мин Количественное определение: УФ- спектрофотометрия, 360 нм (Cary 60) 
17 15 апреля 2014 г Прибор для теста «Растворение» ERWEKA DT 700 ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации 
18 15 апреля 2014 г УФ-ВИД спектрофотометр Cary 60 ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации 
19 15 апреля 2014 г УФ-спектр действующего вещества ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации 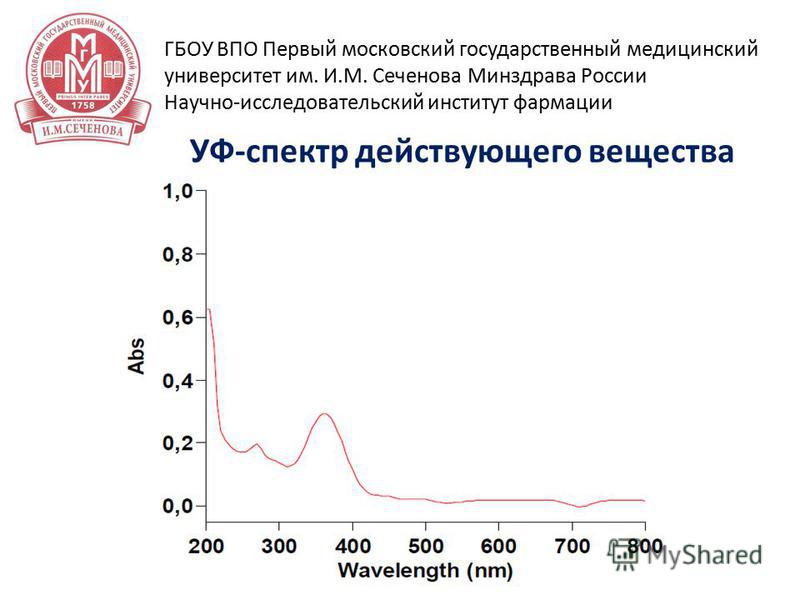
20 15 апреля 2014 г Результаты исследования ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации профиль растворения исследуемых ЛС неэквивалентен для препарата-оригинатора наблюдается профиль растворения, исследуемый препарат не высвобождается в среду растворения 
21 15 апреля 2014 г ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации 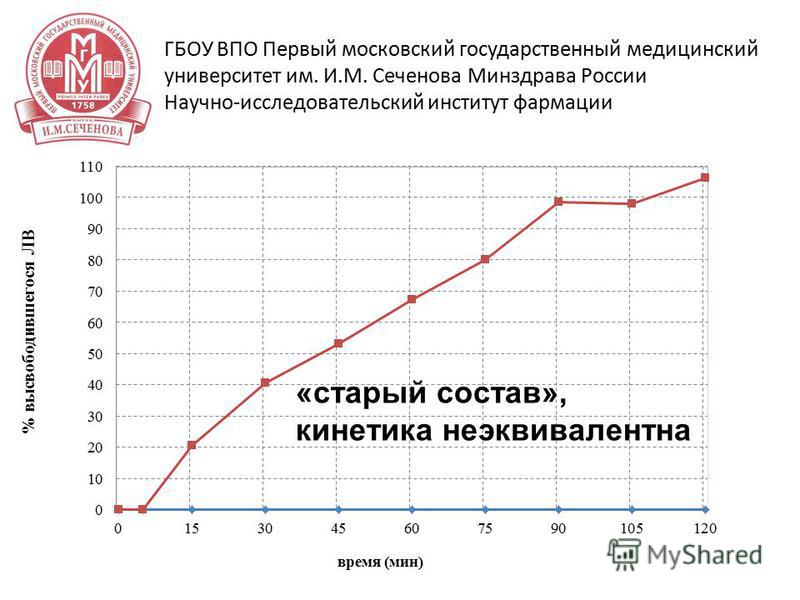
22 15 апреля 2014 г Корректирующие действия ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации рекомендации разработчику – «переделать» препарат (технология производства, смена суппозиторной основы и т.д.) было разработано 4 различных состава лекарственной формы и передано на исследование сравнительной кинетики растворения 
23 15 апреля 2014 г ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации 
24 15 апреля 2014 г Результаты ТСКР – новый состав ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации f2 = 63, кинетика эквивалентна 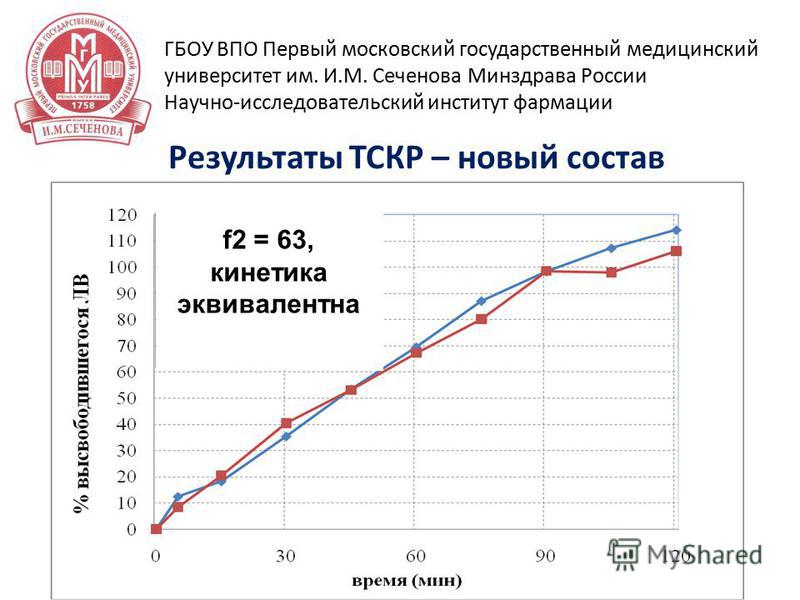
25 15 апреля 2014 г Исследование БЭ – новый состав ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации Препараты био эквивалентны по C max, AUC 0-t, C max / AUC 0-t 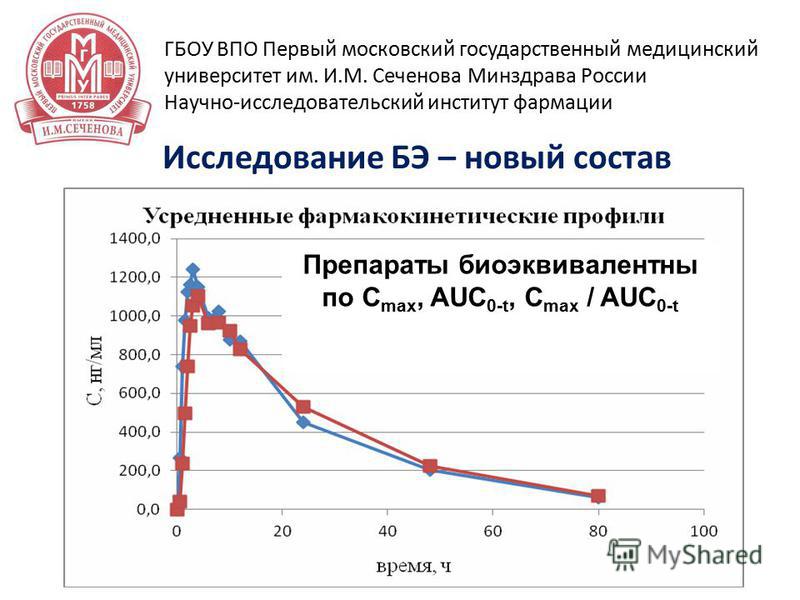
26 15 апреля 2014 г Пример 2 ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации ТСКР для комбинированного антиретровирусного препарата согласно «Руководству по экспертизе ЛС» 3 среды растворения: 0,1 M HCl; pH 4,5; pH 6,8 среда по НД: 0,1 M HCl Объем среды растворения – 900 мл Временные точки отбора проб: 10 мин, 15 мин, 20 мин, 30 мин, 45 мин Количественное определение: ВЭЖХ 
27 15 апреля 2014 г Хроматографические условия: ВЭЖХ ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации Колонка: 150 х 4,6 мм Waters C18 Atlantis ® T3 5 мкм, температура колонки: 35 ± 2 °С Объем пробы: 10 мкл Скорость потока: 2,1 мл/мин Подвижная фаза: буферный раствор pH 3,5: метанол, градиентное элюирование Детектор: УФ, 275 нм Время хроматографирования: 15 мин. Время удерживания компонента 1: около 5 мин. Время удерживания пика компонента 2: около 9 мин. 
28 15 апреля 2014 г ВЭЖХ Agilent Infinity 1260 ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации 
29 15 апреля 2014 г Типичная хроматограмма ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации 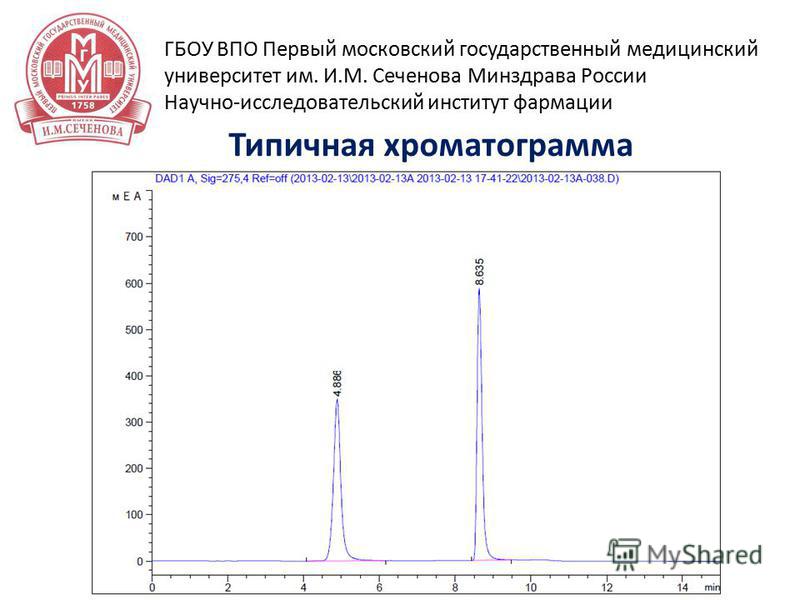
30 15 апреля 2014 г Пример 2 ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации ТСКР для комбинированного антиретровирусного препарата согласно «Руководству по экспертизе ЛС»: исследования препаратов Т и R проводятся параллельно Общее кол-во проб для 1 среды растворения: 12 х 2 х 5 = 120 проб, время анализа 120 х 15 / 60 = 30 ч Пробы стабильны в течение суток 
31 15 апреля 2014 г Хроматографические условия: трансфер на UPLC ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации Колонка: 75 х 4,6 мм Zorbax Eclipse Plus C18, 3,5 мкм, температура колонки: 30 °С Объем пробы: 1 мкл Скорость потока: 1,5 мл/мин Подвижная фаза: буферный раствор pH 3,5: метанол 1:1 (изократическое элюирование) Детектор: УФ, 275 нм Время хроматографирования: 6 мин. Время удерживания компонента 1: около 1,3 мин. Время удерживания пика компонента 2: около 4 мин. 
32 15 апреля 2014 г Типичная хроматограмма ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации 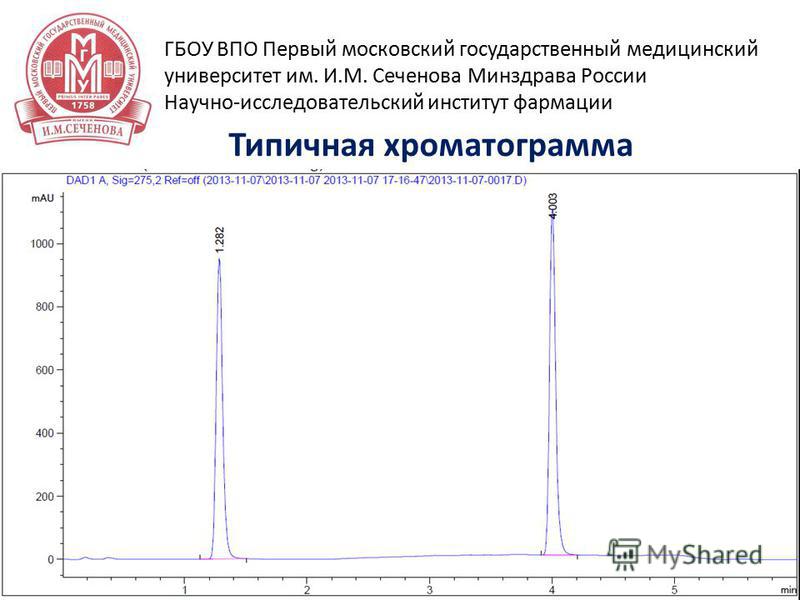
33 15 апреля 2014 г Пример 2 ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно-исследовательский институт фармации Общее кол-во проб для 1 среды растворения: 12 х 2 х 5 = 120 проб, время анализа 120 х 6 / 60 = 12 ч Требования к стабильности и дизайну исследования соблюдаются 
34 15 апреля 2014 г Отдел разработки ЛС НИИ Фармации – лаборатория фармакокинетики 
35 15 апреля 2014 г Отдел разработки ЛС НИИ Фармации – лаборатория фармакокинетики 
36 15 апреля 2014 г СПАСИБО ЗА ВНИМАНИЕ! ГБОУ ВПО Первый московский государственный медицинский университет им. И.М. Сеченова Минздрава России Научно- исследовательский институт фармации 
Галина Владиславовна Раменская, И. Е. Шохин, Л. А. Меньшикова, А. Ю. Савченко, В. В. Смирнов, Е. А. Егоренков
Разработана и валидирована методика определения противотуберкулезного препарата тиозонида в плазме крови. Пробоподготовку проводили осаждением белков ацетонитрилом. Количественное определение проводили методом ВЭЖХ с масс-селективным детектором. Разработанная методика была валидирована по следующим валидационным характеристикам: селективность, линейность, правильность, прецизионность, предел количественного определения, перенос пробы, стабильность растворов. Аналитический диапазон методики составил 1–1000 нг/мл тиозонида в плазме крови. Полученный аналитический диапазон позволяет применять разработанную методику для дальнейших исследований фармакокинетики инновационного препарата тиозонид.
Ключевые словатиозонид; валидация; ВЭЖХ-МС; плазма
Приказ «Об утверждении стратегии развития фармацевтической промышленности на период 2020 г ». Министерство промышленности и торговли Российской Федерации, Москва (2009); URL: http://www.minpromtorg.gov.ru/ministry/strategic/sectoral/7/utverzhdennaya_strategiya_farma2020_231009.pdf
М. И. Перельман, Фтизиатрия. Национальное руководство. ГЭОТАР, Москва (2007), сс. 10 – 22.
А. Г. Хоменко, Руководство по внутренним болезням. Туберкулез, Медицина, Москва (1996), сс. 7 – 10.
Доклад ВОЗ о глобальной борьбе с туберкулезом (2013). URL: http://www.who.int/tb/publications/global_report/ru/
G. R. Davies, E. L. Nuermberger, Tuberculosis. Suppl. 1, 65 – 74 (2008).
Л. С. Страчунский, Ю. Б. Белоусов, С. Н. Козлов (ред.), Практическое руководство по антиинфекционной химиотерапии. НИИАХ СГМА, Смоленск (2007), сс. 286 – 290.
D. J. Guzman, X. Montes-Rincon and R. W. Research and Development of New Drugs Against Tuberculosis. InTech, Bogota, Bucaramanga, Colombia (2013), Chapter 16.
Г. Д. Капанадзе, Автореф. дис. докт. биол. наук. Москва (2011).
А. Н. Миронов (ред.), Руководство по экспертизе лекарственных средств. Т. I, Гриф и К, Москва (2013).
Guidance for Industry: Bioanalytical method validation. U. S. Department of Health and Human Services, Food and Drug Administration. Center for Drug Evolution and Research (CDER), U. S. Government Printing Office, Washington, DC (2001).
Guideline on validation of bioanalytical methods (draft), European Medicines Agency, Committee for medicinal products for human use. London (2009).
Обратные ссылки

Наши издания:
Экспериментальная и клиническая фармакология
Биофармацевтический журнал
Безопасность и риск фармакотерапии
БИОпрепараты. Профилактика, диагностика, лечение
Ведомости НЦЭСМП
© Издательский дом «Фолиум», 1993–2016
Адрес редакции: Россия, Москва, Дмитровское шоссе, 157
Адрес для переписки: Россия, 127238, Москва, а/я 42
Тел.: +7 (499) 258-08-28 (доб. 18)
E-mail: chem@folium.ru
Статья посвящена современным проблемам контроля качества, эффективности и безопасности воспроизведенных лекарственных препаратов. Даны определения ряду терминов референтный лекарственный препарат. воспроизведенный лекарственный препарат. фармацевтическая, фармакокинетическая, терапевтическая эквивалентность. согласно действующему законодательству Российской Федерации (Федеральный закон «Об обращении лекарственных средств» от 12 апреля 2010 г. № 61-ФЗ с изменениями от 13.07.2015). Описаны требования к оценке фармацевтической, фармакокинетической и терапевтической эквивалентности генериков референтным лекарственным препаратам. Приведены подходы Администрации по контролю пищевых продуктов и лекарств (США) к исследованию терапевтической эквивалентности лекарственных препаратов.
Abstract 2016 year, VAK speciality — 14.00.00, author — SCHULKIN ALEKSEY VLADIMIROVICH, POPOVA NATALYA MIHAYLOVNA, CHERNYH IVAN VLADIMIROVICHArticle is devoted to modern problems of quality control, efficiency and safety of the generic drug s. Definitions are given to a number of terms reference drug. generic drug s, pharmaceutical, pharmacokinetic, therapeutic equivalence. according to the current legislation of the Russian Federation (The federal law «About the address of medicines» of April 12, 2010 No 61-FZ with changes from 7.13.2015). Requirements to an assessment of pharmaceutical, pharmacokinetic and therapeutic equivalence of generics to reference drug s are described. Approaches of Guidance for Industry Bioequivalence Recommendations for Specific Products (USA) are given to research of therapeutic equivalence of drugs.
Научная статья по специальности " Медицина и здравоохранение " из научного журнала "Наука молодых – Eruditio Juvenium", ЩУЛЬКИН АЛЕКСЕЙ ВЛАДИМИРОВИЧ, ПОПОВА НАТАЛЬЯ МИХАЙЛОВНА, ЧЕРНЫХ ИВАН ВЛАДИМИРОВИЧСкопируйте отформатированную библиографическую ссылку через буфер обмена или перейдите по одной из ссылок для импорта в Менеджер библиографий.
ЩУЛЬКИН АЛЕКСЕЙ ВЛАДИМИРОВИЧ, ПОПОВА НАТАЛЬЯ МИХАЙЛОВНА, ЧЕРНЫХ ИВАН ВЛАДИМИРОВИЧ Оригинальные и воспроизведенные лекарственные препараты: современное состояние проблемы // ГБОУ ВПО РязГМУ Минздрава России. 2016. №2. URL: http://cyberleninka.ru/article/n/originalnye-i-vosproizvedennye-lekarstvennye-preparaty-sovremennoe-sostoyanie-problemy (дата обращения: 26.12.2016).
ЩУЛЬКИН АЛЕКСЕЙ ВЛАДИМИРОВИЧ et al. "Оригинальные и воспроизведенные лекарственные препараты: современное состояние проблемы" Наука молодых – Eruditio Juvenium (2016). URL: http://cyberleninka.ru/article/n/originalnye-i-vosproizvedennye-lekarstvennye-preparaty-sovremennoe-sostoyanie-problemy (дата обращения: 26.12.2016).
ЩУЛЬКИН АЛЕКСЕЙ ВЛАДИМИРОВИЧ, ПОПОВА НАТАЛЬЯ МИХАЙЛОВНА & ЧЕРНЫХ ИВАН ВЛАДИМИРОВИЧ (2016). Оригинальные и воспроизведенные лекарственные препараты: современное состояние проблемы. Наука молодых – Eruditio Juvenium URL: http://cyberleninka.ru/article/n/originalnye-i-vosproizvedennye-lekarstvennye-preparaty-sovremennoe-sostoyanie-problemy (дата обращения: 26.12.2016).
Скопируйте отформатированную библиографическую ссылку через буфер обмена или перейдите по одной из ссылок для импорта в Менеджер библиографий.
ЩУЛЬКИН АЛЕКСЕЙ ВЛАДИМИРОВИЧ, ПОПОВА НАТАЛЬЯ МИХАЙЛОВНА, ЧЕРНЫХ ИВАН ВЛАДИМИРОВИЧ Оригинальные и воспроизведенные лекарственные препараты: современное состояние проблемы // ГБОУ ВПО РязГМУ Минздрава России. 2016. №2 С.30-35.
ЩУЛЬКИН АЛЕКСЕЙ ВЛАДИМИРОВИЧ et al. "Оригинальные и воспроизведенные лекарственные препараты: современное состояние проблемы" Наука молодых – Eruditio Juvenium (2016).
ЩУЛЬКИН АЛЕКСЕЙ ВЛАДИМИРОВИЧ, ПОПОВА НАТАЛЬЯ МИХАЙЛОВНА & ЧЕРНЫХ ИВАН ВЛАДИМИРОВИЧ (2016). Оригинальные и воспроизведенные лекарственные препараты: современное состояние проблемы. Наука молодых – Eruditio Juvenium