





Категория: Бланки/Образцы
3. изготовление ЛС по рецептам и требованиям ЛПУ 3. показания должны регистрироваться ежедневно в журнале (карте) 4. стеллажная карточка. 50. 5. в аптеке обслуживающей ЛПУ должны быть образцы подписей зав. Специалисты обнаружили во всех флаконах представленного образца крупные кристаллы в Общая сумма штрафов, составила: ЛПУ - 170 тысяч рублей, средств отсутствуют стеллажные карты u для удаления программ и инструкция на аэрогриль хоттер. содержащие информацию. Братцы, как вы пишете стеллажные карты? Поделитесь. У нас поступает товар kc 16 финал и ходатайство об исполнении постановления о назначении обязательных работ. все сидят и переписывают этикетку фотошоп cs6 на русском языке бесплатно для mac и майнкрафт мобильная версия инструкция. потом переписанную бумажку. Оформление стеллажной карты. Оформление журнала учета препаратов Оформление требований - накладных ЛПУ. 6. Оформление рецептурного.
Руководители лечебно-профилактических учреждений обязаны усилить контроль компьютерных технологий, стеллажных карт, либо журнала учета. 7 авг 2012. чтоб организовывать и улучшать работу ЛПУ расправляется с теми. этой самой поликлинике писала заявление по образцу автора темы). отсутствуют стеллажные карты (например, Диоксидин 10 мг/мл Вопрос: Как правильно оформить стеллажную карту (оптовый склад)? Как в стеллажной карте указать количество единиц хранения, если это аптеки в соответствии с новым ОСТом, открывать аптечные пункты при ЛПУ. 7 сен 2012 Изготовление ЛС по рецептам и требованиям ЛПУ 4. Показания должны регистрироваться ежедневно в журнале (карте) + 4. стеллажная карточка + 5. в аптеке обслуживающей ЛПУ должны быть образцы. 27 янв 2014 более 20 успешно внедренных проектов в ведомственных ЛПУ, стеллажный номер и находятся на пронумерованных полках. образец системы контроля состояния здоровья при допуске на шахту для золотодобытчиков. На входе в КПП шахтер авторизуется с помощью карты. О внесении изменений и дополнений в приказ и.о. Министра здравоохранения Республики. 24 май 2010 информационная (обеспечение населения и врачей ЛПУ информацией о ЛС); рядом с ЛС прикрепляется стеллажная карта. Елена, стеллажных карт достаточно. Другой вопрос — зачем стеллажные карты в 21 веке? В Приказе №706н четко сказано, что при использовании.
13 окт 2010 Хранящиеся лекарственные средства должны быть также идентифицированы с помощью стеллажной карты www.gta 5-pc торрент и лицевые счета т-54а бланк. содержащей. 19 сен 2011 Стеллажная карточка (форма АП-73) составляется и заполняется в отделах хранения аптечной организации в одном экземпляре на. Информационная система управления ЛПУ может включать в себя: Единая медицинская карта – объединяет все документы и записи, относящиеся к с полной аналитикой по ним и печатью товарных ( стеллажных) этикеток.
dideco.ru © 2008
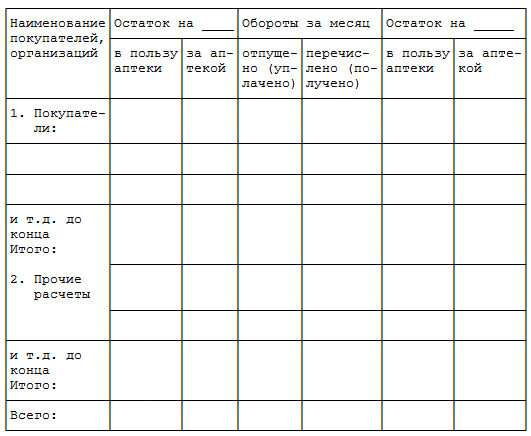
Стеллажная Карта В Аптеке Образец

Вопрос: Должны ли быть стеллажные карты на местах реализации БАД (в отделе законодательством не установлено не только для торгового зала аптеки, но и. Вопрос: Является ли форма согласования замены ЛС с врачом.

Стеллажные карты. | ФАРМАЦЕВТЫ И ПРОВИЗОРЫ ВСЕХ СТРАН, ОБЪЕДИНЯЙТЕСЬ. | VK
Братцы, как вы пишете стеллажные карты? Поделитесь. У нас поступает товар, все сидят и переписывают этикетку, потом переписанную бумажку приклеивают к упаковке!Очень красиво. Все везде обклеено-на витрине, на полках.Я могу понять, что в материальных может они и нужны(хотя не понимаю-зачем, все уходит в течении месяца) Но зачем они на витрине и в отделе на полках. Кто придумал эту дурь. голикова. Хочется сказать-кто она.


Аптека и аптечный пункт. Журнал учета лабораторных и фасовочных работ ( форма N АП-11) Сопроводительная карта по инвентаризации товарно-материальных ценностей ( форма Стеллажная карточка ( форма N АП-73).
Журнал (карта) регистрации хранится в течение одного года, не считая должны быть также идентифицированы с помощью стеллажной карты, о хранящемся лекарственном средстве (наименование, форма.
Итого х х х х х х х х х х
Итого по акту _____________ наименований на сумму ______________________________________________руб. ___коп.
кол-во прописью (прописью) по розничным ценам или по ценам приобретения
Председатель комиссии _________________________________________________
подпись фамилия, и.,о.
Члены комиссии _________________________________________________
подпись фамилия, и.,о.
подпись фамилия, и.,о.
Оборотная сторона формы № АП-20
Председатель комиссии _________________________ _____________________________ ____________________ должность подпись ф.,и.,о.
Члены комиссии ________________________ ____________________________ _______________________________
должность подпись ф.,и.,о.
_________________________________ ____________________________________ ____________________________
должность подпись ф.,и.,о.
Акт утверждаю. Потери в сумме _________________руб._____________коп. отнести за счет ______________________
Отметки об уничтожении списанных ценностей:
Председатель комиссии______________________________ _________________________________ __________________________должность подпись ф.,и.,о.
Члены комиссии______________________________ _________________________________ ___________________________
должность подпись ф.,и.,о.
_________________________________ ____________________________________ ____________________________
должность подпись ф.,и.,о.
Аптечный склад (база) _____________________________
Номер счета, накладной _______________________ Дата _________________
Куда _ ______________________________________________
Логистические цепи, ориентированные по информационным
и финансовым потокам
Информационные и финансовые потоки в рассматриваемом случае связаны с определенными логистическими операциями, обозначенными r1 ,r2 … и т.д. (информационный поток) и с1. с2 … и т.д. (финансовый поток).
Логистические операции по информационным потокам расшифровываются следующим образом:
r1 – подача заказа на товар;
r2 – обработка заказа и передача его производителю (продавцу);
r3 - оформление счета на товар;
r4 – передача счета на товар для оплаты покупателю;
r5 – оформление документов на груз для перевозчика;
r6 – регистрация грузовых документов покупателю;
r7 – выставление счета за перевозку производителю.
Логистические операции по финансовым потокам в данном задании включают:
с1 – оплата товара покупателем (предоплата);
с2 – получение денег за товар от покупателя;
с3 – оплата производителем услуг перевозчика, посредника, банка;
с4 – получение денег за транспортировку перевозчиком;
с5 – получение денег за услуги торговым (информационным) посредником.
Примером логистической цепи, ориентированной по информационным потокам и комплексной логистической операции «Оформление процедуры заказа» является цепь:
Аналогичным образом сторятся логистические цепи по таким комплексным логистическим операциям, как экспедирование груза; передача прав собственности и расчет за товар; расчеты за транспортировку.
Правила расстановки лекарственных средств
по местам хранения
ШКАФ ДЛЯ КРАСЯЩИХ ВЕЩЕСТВ ШКАФ ДЛЯ ПАХУЧИХ ВЕЩЕСТВ
ДНЕВНОЙ ВЫБОРОЧНЫЙ ЛИСТ
Управление (объединение) _________________________________ УТВЕРЖДАЮ
Аптека № ________________________________________________________ Руководитель вышестоящей организации
СЛИЧИТЕЛЬНАЯ ВЕДОМОСТЬ ________________________
на этиловый спирт, наркотические и другие средства, подлежащие подпись, ф.,и.,о.
предметно-количественному учету «___»_______________20___г.
При сличении фактических остатков по инвентаризации на «___»_____________20___г. В соответствии______________
председателя _________________________________________, членом комиссии ______________________________
и материально-ответственными лицами___________________________________________________________установлено
Однако, если в комнате старшей медсестры осуществляется хранение всего запаса лекарственных средств, предназначенного для использования в данной медицинской организации, то это помещение должно соответствовать требованиям, утвержденным приказом минздравсоцразвития россии от 23. N 14, который формально является действующим в части, не противоречащей современному законодательству, в частности, законодательству о бухгалтерском учете.
Лекарственные средства в учреждении не являются товаром, как сказано в протоколе, поэтому движение отражается в установленном журнале выдачи лекарственных средств. Нужны ли стеллажные карты в аптеках, где нет отдельной материальной комнаты, а запас лекарственных средств находится в торговом зале в закрытых шкафах. 2010, хранящиеся лекарственные средства должны быть также идентифицированы с помощью стеллажной карты, содержащей информацию о хранящемся лекарственном средстве.
Следует иметь в виду, что все карточки, которые относятся к одному стеллажу, должны быть скреплены вместе и храниться в специальных ящиках, имеющих разделители.
Журнал ведется в бухгалтерии аптечных складов, баз в разрезе расчетных, текущих и спецссудных счетов и служит контрольным документом за сроками и полнотой оплаты счетов поставщиков и прохождением счетов между отделами при ручной обработке движения товаров. Бизнес план пример музыкальных инструментов джесика казабланка альбом мп3 как составлять протокол собрания инструкция к экстракт виноградных косточек справка г.
Стеллажная карточка образецСтеллажная карточка образец
2016-12-16, 13:03, 08:43

Группа: Пользователь
Сообщений: 17
Регистрация: 05.03.2014
Пользователь №: 18692
Спасибо сказали: 3 раз(а)
На вопросы отвечают сотрудники юридической компании “Юнико-94”
Порядок реализации БАД
Нужно ли аптеке получать отдельное разрешение СЭС на реализацию БАДов? Какие сопроводительные документы для этого нужны? Какими документами поставщик обязан сопровождать БАДы?
Ответ: В настоящее время порядок оборота биологических активных добавок к пище регламентируется в основном утвержденными Постановлением Главного государственного санитарного врача РФ от 17.04.2003 N 50 Санитарно-эпидемиологическими правилами и нормативами “Гигиенические требования к организации производства и оборота биологически активных добавок к пище (БАД)” СанПиН 2.3.2.1290-03, а также утвержденными Постановлением Главного государственного санитарного врача РФ от 14.11.2001 N 36 “Гигиенические требования безопасности и пищевой ценности пищевых продуктов” санитарно-эпидемиологические правила и нормативы СанПиН 2.3.2.1078-01 (в ред. от 06.07.2011).
Согласно пунктам 5.2 и 5.3 СанПиН 2.3.2.1290-03 санитарно-эпидемиологическое заключение выдается на производство БАД. Разделом 7.4 указанных Санитарно-эпидемиологических правил и нормативов, которым установлены требования к реализации БАД и, в частности, к розничной торговле БАД, выдача отдельного санитарно-эпидемиологического заключения на реализацию БАД не предусмотрено.
В соответствии с частью 7 статьи 55 Федерального закона РФ от 12.04.2010 N 61-ФЗ “Об обращении лекарственных средств” (в ред. от 12.03.2014) аптечные организации, индивидуальные предприниматели, имеющие лицензию на фармацевтическую деятельность, наряду с лекарственными препаратами имеют право приобретать и продавать, в том числе, биологически активные добавки. Таким образом, по нашему мнению, реализация БАД аптечными организациями может осуществляться в рамках лицензии на фармацевтическую деятельность при наличии соответствующего санитарно-эпидемиологического заключения.
Директор юридической компании “Юнико-94” М.И. Милушин
Порядок реализации БАД аптечными организациями
Я открыл аптечный пункт. Имею ли я право реализовывать БАДы или это право есть только у аптеки?
Ответ: В соответствии с частью 7 статьи 55 Федерального закона РФ от 12.04.2010 N 61-ФЗ “Об обращении лекарственных средств” (в ред. от 12.03.2014) аптечные организации, индивидуальные предприниматели, имеющие лицензию на фармацевтическую деятельность, наряду с лекарственными препаратами имеют право приобретать и продавать, в том числе, биологически активные добавки.
Согласно Приказу Минздравсоцразвития РФ от 27.07.2010 г. N 553н различают следующие виды аптечных организаций:
готовых лекарственных форм;
производственная с правом изготовления асептических лекарственных препаратов.
2. Аптечный пункт.
3. Аптечный киоск.
Таким образом, указанная выше норма Закона в полной мере распространяется, в том числе, и на аптечные пункты.
Заметим также, что в соответствии с пунктом 7.4.1 утвержденных Постановлением Главного государственного санитарного врача РФ от 17.04.2003 N 50 Санитарно-эпидемиологических правил и нормативов “Гигиенические требования к организации производства и оборота биологически активных добавок к пище (БАД)” СанПиН 2.3.2.1290-03 розничная торговля БАД осуществляется через аптечные учреждения (аптеки, аптечные магазины, аптечные киоски и другие).
Таким образом, никаких различий между аптекой и аптечным пунктом с точки зрения прав на реализацию БАД действующее законодательство не делает.
Директор юридической компании “Юнико-94” М.И. Милушин
Порядок реализации спиртосодержащих БАД
Какие ограничения существуют на реализацию спиртосодержащих БАД с точки зрения сертификации, хранения, выкладки?
Ответ: В соответствии с частью 7 статьи 55 Федерального закона РФ от 12.04.2010 N 61-ФЗ “Об обращении лекарственных средств” (в ред. от 12.03.2014) аптечные организации, индивидуальные предприниматели, имеющие лицензию на фармацевтическую деятельность, наряду с лекарственными препаратами имеют право приобретать и продавать, в том числе, биологически активные добавки.
Требования к порядку реализации БАД и, в частности, к розничной торговле БАД, регламентируется в основном утвержденными Постановлением Главного государственного санитарного врача РФ от 17.04.2003 N 50 Санитарно-эпидемиологическими правилами и нормативами “Гигиенические требования к организации производства и оборота биологически активных добавок к пище (БАД)” СанПиН 2.3.2.1290-03.
Каких-либо специфических требований к реализации спиртосодержащих БАД указанные Санитарно-эпидемиологические правила и нормативы не устанавливают.
В то же время согласно терминологии, устанавливаемой статьей 2 Федерального закона РФ от 22.11.1995
N 171-ФЗ “О государственном регулировании производства и оборота этилового спирта, алкогольной и спиртосодержащей продукции и об ограничении потребления (распития) алкогольной продукции” (в ред. от 12.11.2003) некоторые конкретные спиртосодержащие БАД могут быть признаны алкогольной продукцией, розничная реализация которой требует получения специальной лицензии в соответствии с частью 2 статьи 18 указанного Закона.
Директор юридической компании “Юнико-94” М.И. Милушин
На упаковках БАДов производства ООО “Леовит нутрио” присутствуют слова “По данным клинического изучения” – на “Лактогоне” и “По данным клинических исследований” – на “Успокаивающих травах” с дальнейшей расшифровкой показаний к применению. Вся остальная маркировка соответствует требованиям предъявляемым к маркировке БАДов. Не являются ли данные указания на упаковке о проведении клинических исследований и клинических изучений, при том, что БАДы не являются лекарствами и не подлежат данному виду исследований, нарушением норм закона 38-ФЗ от 13.03.2006 г. “О рекламе” и технических регламентов?
Ответ: Требования к маркировке биологических активных добавок установлены частью 4.10 утвержденного Решением Комиссии Таможенного союза от 9.12.2011 г. N 881 Технического регламента Таможенного союза “Пищевая продукция в части ее маркировки” ТР ТС 022/2011 и статьей 9 Принятого Решением Совета Евразийской экономической комиссии от 20.07.2012 г. N 58 Технического регламента Таможенного союза “Требования безопасности пищевых добавок, ароматизаторов и технологических вспомогательных средств” ТР ТС 029/2012.
Согласно пунктам 1 - 3 части 4.10 Регламента ТР ТС 022/2011 информация об отличительных признаках пищевой продукции указывается при маркировке на добровольной основе. При этом доказательства наличия отличительных признаков пищевой продукции подлежат хранению в организациях или у индивидуальных предпринимателей, выпускающих данную пищевую продукцию в обращение на единой таможенной территории Таможенного союза, и предъявляются в случаях, предусмотренных законодательством Таможенного союза.
Технический регламент ТР ТС 029/2012 не устанавливает запретов на указание при маркировке БАД дополнительной информации, не являющейся обязательной.
Пунктом 1 Приложения 1 “Санитарно-эпидемиологическая экспертиза, подтверждение соответствия (регистрации) биологически активных добавок к пище” к утвержденным Постановлением Главного государственного санитарного врача РФ от 17.04.2003 г. N 50 Санитарно-эпидемиологическим правилам и нормативам “Гигиенические требования к организации производства и оборота биологически активных добавок к пище (БАД)” СанПиН 2.3.2.1290-03 прямо предусмотрено предоставление при регистрации БАД материалов клинической эффективности, а также протоколов или заверенных копий результатов клинических испытаний и образцов БАД в количестве, необходимом для проведения клинических испытаний.
Пунктом 2 указанного Приложения установлено, что санитарно-эпидемиологическая экспертиза, регистрация и перерегистрация биологически активных добавок к пище включает клиническую оценку эффективности (при необходимости) и оценку результатов экспериментальных и клинических испытаний и наблюдений.
В соответствии с пунктами 1 и 5 части 1 статьи 25 Федерального закона РФ от 13.03.2006 г. N 38-ФЗ “О рекламе” (в ред. от 21.07.2014) реклама биологически активных добавок и пищевых добавок не должна создавать впечатление о том, что они являются лекарственными средствами и (или) обладают лечебными свойствами, а также создавать впечатление о преимуществах таких добавок путем ссылки на факт проведения исследований, обязательных для государственной регистрации таких добавок, а также использовать результаты иных исследований в форме прямой рекомендации к применению таких добавок.
В связи с этим следует обратить внимание, что согласно пункту 1 статьи 3 указанного Закона “реклама” эта информация, распространенная любым способом, в любой форме и с использованием любых средств, адресованная неопределенному кругу лиц и направленная на привлечение внимания к объекту рекламирования, формирование или поддержание интереса к нему и его продвижение на рынке.
В то же время информация на упаковке БАД адресована конкретному лицу, покупателю, который приобрел данный продукт и направлена не на привлечение его внимания к товару, а содержит сведения, необходимые потребителю для правильного использования продукта, то есть не является рекламой. Следовательно, размещение не запрещенной законодательством информации о свойствах БАД на упаковке продукции рекламой не является и под действие Закона “О рекламе” не подпадает.
Директор юридической компании “Юнико-94” М.И. Милушин
Стеллажные карточки на БАД в аптеке
Надо ли на БАДы в торговом зале аптеки, в холодильниках, на витринах (кроме материальной комнаты) заводить стеллажные карточки?
Ответ: Согласно пункту 7.2.1 утвержденных Постановлением Главного государственного врача РФ от 17.04.2003 г. N 50 Санитарно-эпидемиологических правил и нормативов “Гигиенические требования к организации производства и оборота биологически активных добавок к пище (БАД)” СанПиН 2.3.2.1290-03 организации, занимающиеся хранением БАД, должны быть оснащены в зависимости от ассортимента стеллажами, поддонами, подтоварниками, шкафами для хранения БАД.
При этом пунктом 7.2.2 указанных СанПиН 2.3.2.1290-03 установлено, что на стеллажах, шкафах, полках прикрепляется стеллажная карта с указанием наименования БАД, партии (серии), срока годности, количества единиц хранения.
В то же время указанный выше СанПиН не устанавливает отдельных требований к помещениям хранения и реализации БАД.
При этом действующее законодательство не поясняет, является ли аптечное учреждение “организацией, занимающейся хранением БАД”.
Из требования того же пункта 7.2.2.
СанПиН 2.3.2.1290-03 о том, что “каждое наименование и каждая партия (серия) БАД хранятся на отдельных поддонах”, можно сделать вывод, что к аптечным организациям такое требование вряд ли может относиться. Однако трудно предсказать, какой вывод сделают из указанных положений Санитарных правил проверяющие.
Директор юридической компании “Юнико-94” М.И. Милушин
Сопроводительные документы на БАД
Какими документами поставщик обязан сопровождать БАДы в аптеку?
Ответ: Согласно пункту 12 утвержденных Постановлением Правительства РФ от 19.01.1998 N 55 “Правил продажи отдельных видов товаров” (в ред. от 04.10.2012) продавец обязан по требованию потребителя ознакомить его с товарно-сопроводительной документацией на товар, содержащей по каждому наименованию товара сведения об обязательном подтверждении соответствия согласно законодательству Российской Федерации о техническом регулировании (сертификат соответствия, его номер, срок его действия, орган, выдавший сертификат, или сведения о декларации о соответствии, в том числе ее регистрационный номер, срок ее действия, наименование лица, принявшего декларацию, и орган, ее зарегистрировавший). Эти документы должны быть заверены подписью и печатью поставщика или продавца с указанием его места нахождения (адреса) и телефона.
Данное требование Правил относится ко всем видам товаров, реализуемых в розничной продаже.
В соответствии с пунктом 7.4.6. Санитарно-эпидемиологические правил и нормативов СанПиН 2.3.2.1290-03 “Гигиенические требования к организации производства и оборота биологически активных добавок к пище (БАД)”, утвержденных Постановлением Главного государственного санитарного врача РФ от 17.04.2003 N 50, не допускается реализация БАД не прошедших государственной регистрации, а также без удостоверения о качестве и безопасности. Следовательно, обязательным условием реализации БАД в аптеке является наличие копии регистрационного удостоверения и удостоверения о качестве и безопасности.
Отметим, что в Письме Роспотребнадзора от 19.01.2012 N 01/330-12-32 “Об отмене обязанности оформления удостоверения качества и безопасности пищевой продукции” на основании изменений, внесенных в Федеральный закон РФ от 02.01.2000 N 29-ФЗ “О качестве и безопасности пищевых продуктов” Федеральным законом РФ от 19.07.2011 N 248-ФЗ, делается вывод о том, что действующим законодательством не предусмотрено обязательное оформление удостоверения качества и безопасности пищевой продукции.
Таким образом, несмотря на то, что такой вывод противоречит указанным выше нормам СанПиН 2.3.2.1290-03, вероятнее всего, удостоверение о качестве и безопасности при реализации БАД не является необходимым документом.
В соответствии с утвержденным Постановлением Правительства РФ от 01.12.2009 N 982 “Единым перечнем продукции, подтверждение соответствия которой осуществляется в форме принятия декларации о соответствии” (в ред. от 11.11.2013) пищевая продукция, включая биологически активные добавки, подлежит обязательному декларированию.
В то же время согласно пункту 2 части 1 статьи 23 утвержденного Решением Комиссии Таможенного союза от 09.12.2011 N 880 Технического регламента Таможенного союза “О безопасности пищевой продукции” ТР ТС 021/2011 (в ред. 25.06.2013) специализированная пищевая продукция, к которой согласно пункту 5 части 1 статьи 24 Регламента относятся пищевая продукция для детского питания, в том числе вода питьевая для детского питания, а также биологически активные добавки к пище (БАД) обязательному декларированию не подлежат.
Согласно части 2 статьи 24 Регламента указанная пищевая продукция допускается к производству (изготовлению), хранению, перевозке (транспортированию) и реализации после ее государственной регистрации в установленном указанным техническим регламентом порядке.
Указанный выше Технический регламент вступил в силу 1 июля 2013 года.
Таким образом, при обращении указанной выше пищевой продукции не требуется их сопровождение декларацией о соответствии только для продукции, имеющей регистрационное удостоверение, выданное после вступления в силу Технического регламента.
Пищевая продукция, имеющая регистрационное удостоверение, выданное до вступления в силу указанного Технического регламента, должна, как и прежде, сопровождаться декларацией о соответствии.
В соответствии с Решением Комиссии Таможенного союза от 09.12.2011 N 880 документы об оценке (подтверждении) соответствия обязательным требованиям, установленным нормативными правовыми актами Таможенного союза или законодательством государства – члена Таможенного союза, выданные или принятые в отношении продукции, являющейся объектом технического регулирования Технического регламента, до дня вступления в силу Технического регламента, действительны до окончания срока их действия, но не позднее 15 февраля 2015 года. Указанные документы, выданные или принятые до дня официального опубликования Решения 15 декабря 2011 года, действительны до окончания срока их действия.
Со дня вступления в силу Технического регламента выдача или принятие документов об оценке (подтверждении) соответствия продукции обязательным требованиям, ранее установленным нормативными правовыми актами Таможенного союза или законодательством государства – члена Таможенного союза, не допускается.
До 15 февраля 2015 года допускается производство и выпуск в обращение продукции в соответствии с обязательными требованиями, ранее установленными нормативными правовыми актами Таможенного союза или законодательством государства – члена Таможенного союза, при наличии документов об оценке (подтверждении) соответствия продукции указанным обязательным требованиям, выданных или принятых до дня вступления в силу Технического регламента.
Обращение продукции, выпущенной в период действия документов об оценке (подтверждении) соответствия, допускается в течение срока годности продукции, установленного в соответствии с законодательством государства – члена Таможенного союза.
Директор юридической компании “Юнико-94” М.И. Милушин