
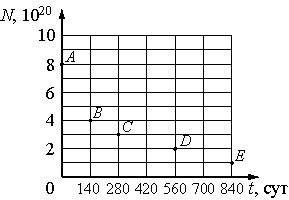




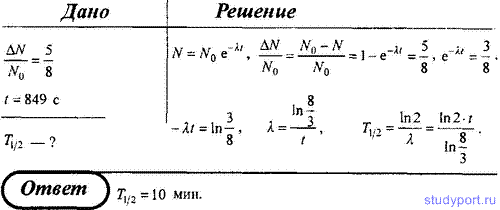
Категория: Бланки/Образцы
Таким способом Энрико Ферми с сотрудниками в первом в мире реакторе «Чикагская поленница-1» впервые получил значительные количества плутония-239, которые были использованы для создания ядерного оружия.
А. с наибольшими порядковыми номерами получены при бомбардировании ядер урана, плутония, кюрия или калифорния ионами азота, кислорода, углерода, неона, бора на ускорителях тяжёлых ионов. Так, один из первых методов синтеза нобелия — бомбардировка мишени из урана-238 ядрами неона-22.
Первые изотопы ТПЭ — америций-241 и кюрий-242 — были синтезированы в 1944 году Г. Сиборгом, Джеймсом и А. Гиорсо. Изотопы кюрия были получены при бомбардировке ядер плутония-239 ионами гелия с энергией 32 МэВ.
Также изотопы америция-241 и кюрия-242 были выделены из плутония, облучённого нейтронами в реакторе, где они образовались в результате ядерных превращений.
При бомбардировании кюрия-242 ?-частицами образуется изотоп калифорния 245Cf. С помощью аналогичной реакции из америция-241 был получен берклий-244.
В 1945 году Кеннингем впервые выделил твёрдое соединение одного из ТПЭ — гидроксид америция. В течение последующих 3—4 лет были накоплены миллиграммовые количества америция и микрограммовые количества кюрия, что позволило, в результате облучения америция и кюрия, синтезировать изотопы берклия (Томсон, 1949 год) и калифорния (Томсон, 1950 год). Весовые количества данных элементов были выделены значительно позже, в 1958 году (Кеннингем и Томсон), а первое соединение калифорния (CfOCl) получено лишь в 1960 году (Кеннингем и Уолмен).
Эйнштейний и фермий были выделены группой американских учёных из Калифорнийского университета, Аргоннской национальной лаборатории иЛос-Аламосской научной лаборатории в 1952—1953 годах из продуктов термоядерного взрыва «Майк», произведённого 1 ноября 1952 года. В результате мгновенного облучения урана-238 большим потоком нейтронов, возникшим при термоядерном взрыве, образовались тяжёлые изотопы урана, в том числе уран-253 и уран-255, при ?-распаде которых в конечном итоге образовались изотопы эйнштейния-253 и фермия-255. Эйнштейний был найден группой американских учёных во главе с А. Гиорсо в 1952 году и назван в честь великого физика — А. Эйнштейна. Фермий впервые был идентифицирован американским учёным А. Гиорсо в 1953 году в виде изотопа фермия-255, указанного выше. Фермий назван в честь итальянского физика Э. Ферми, внёсшего большой вклад в развитие современной теоретической и экспериментальной физики. Первые весовые (субмикрограммовые) количества эйнштейния выделены в 1961 году Кеннингемом и сотрудниками. Фермий и более ТПЭ с большими порядковыми номерами до настоящего времени не получены в весовых количествах.
Первый изотоп менделевия 256Md был синтезирован в феврале 1955 года (Г. Сиборг и сотрудники) при облучении эйнштейния-253 ионами гелия. Для синтеза следующих за менделевием элементов пришлось использовать новый метод — облучение ядер урана и трансурановых элементов тяжёлыми многозарядными ионами. Ввиду исключительно малого выхода и коротких периодов полураспада изотопов трансменделевиевых элементов, синтезируемых в этих реакциях, их идентификация оказалась очень сложной и не всегда надёжной. Как правило, в первых работах по синтезу элементов с Z?102 полученные изотопы идентифицировались чисто физическими методами, по характеру излучения и дочерним продуктам распада.
Попытки получения изотопов нобелия велись с 1957 года, но первым надёжным результатом следует считать синтез изотопа нобелия 256No, который был проведён Г. Флёровым в 1963 году. Для получения данного изотопа использовался неон-22.
В 1961 году А. Гиорсо и сотрудниками был получен первый изотоп лоуренсия путём облучения калифорния (в основном калифорния-252) ионами бора-10 и бора-11; массовое число этого изотопа не было точно установлено (возможно, 258 или 259) на тот момент. Более надёжно идентифицирован изотоп лоуренсия 256Lr, синтезированный в 1965 году Г. Флёровым с помощью нуклидов 243Am и 18O.
К 1982 году было известно 24 изотопа актиния, на данный момент известны 31 изотоп актиния и ещё 8 возбужденных изомерных состояний некоторых его нуклидов. В природе были найдены три изотопа — 225Ac, 227Ac и 228Ac, остальные получаются искусственным путём. На практике применяют три природных изотопа. Актиний-225 является членом радиоактивногоряда нептуния; был впервые обнаружен в 1947 году в качестве продукта распада урана-233. Если выдержать 1 г урана-233 в течение года, то активность образовавшегося в образце 225Ac составит 1,8?106 расп/мин. Данный нуклид является ?-излучателем с периодом полураспада 10 сут. Актиний-225 по сравнению с актинием-228 менее доступен, но в практическом отношении как радиоактивный индикатор является более перспективным[6].
Актиний-227 — член радиоактивного ряда урана-актиния. Встречается во всех урановых рудах, однако в малых количествах. На один грамм урана при радиоактивном равновесии приходится всего 2?10?10 г 227Ac. Период полураспада изотопа 227Ac составляет 21,77 лет[6][7].
Актиний-228 является членом радиоактивного ряда тория; был открыт О. Ганом в 1906 году. Данный изотоп образуется при распаде 228Ra. В 1 т тория содержится 5?10?8 г 228Ac. Изотоп является ??-излучателем с периодом полураспада 6,15 ч.
Из изотопов протактиния известны 29 нуклидов с массовыми числами 212—240[7] и 3 возбужденных изомерных состояния некоторых его нуклидов. Из этого количества только два нуклида — 231Pa и 234Pa — встречаются в природе, остальные — синтезируются. Продолжительность жизни всех изотопов, за исключением протактиния-231, невелика. С практической точки зрения наиболее важными являются долгоживущий изотоп 231Pa и искусственный 233Pa. Протактиний-233 является промежуточным продуктом при получении урана-233, он же является наиболее доступным среди других искусственных изотопов протактиния. По своим физическим свойствам (период полураспада, энергия ?-излучения и др.) является удобным веществом для химических исследований. Благодаря данному изотопу было получено очень много ценных химических сведений по химии протактиния. Радиационная активность протактиния-233 составляет
20000 Ки. Протактиний-233 является ?-излучателем с периодом полураспада 26,97 дня.
Уран имеет 25 его изотопов с массовыми числами 217—242[13]. Для урана известно наличие 6 изомерных состояний некоторых его нуклидов. В природе в заметных количествах уран находится в виде трёх изотопов — 234U, 235U и 238U. Из всех остальных важнейшим является 233U, который получается как конечный продукт превращений при облучении 232Thзамедленными нейтронами. Ядро 233U обладает эффективным поперечным сечением деления на тепловых нейтронах, по сравнению с 235U. Из большинства изотопов урана наиболее удобным для изучения химических свойств считается уран-238, так как период полураспада составляет 4,4?109 лет.
В наше время известно 19 изотопов нептуния с массовыми числами от 225 до 244. Для работы с изотопами обычно применяются долгоживущий 237Np (T?=2,20?106 лет) и короткоживущие 239Np, 238Np. Важнейшим из них является нептуний-237. Данный изотоп наиболее пригоден для исследования физических и химических свойств. Спектр данного изотопа является очень сложным и состоит из более 20 моноэнергетических линий. Применение больших количеств 239Np в химической лаборатории осложняется его высокой радиоактивностью.
Для большинства нуклидов нептуния с массовым числом от 231 до 241 разброс в значениях периода полураспада составляет от 7,3 мин (240mNp) до 2,2?106 лет.
Для изотопов америция на данный момент известно 16 нуклидов с массовыми числами от 232 до 248[13]. Важнейшими из них являются 241Am и 243Am, оба являются альфа-излучателями; имеют мягкое, но интенсивное ?-излучение; оба они могут быть получены в изотопически чистом виде. Химические свойства америция были изучены в основном на 241Am, однако в дальнейшем стали доступны весовые количества 243Am, который более удобен для химических исследований, так как почти в 20 раз менее активен, чем америций-241. Недостатком изотопа 243Am является наличие короткоживущего дочерноего изотопа нептуния-239, с которым приходится считаться при определении по ?-активности.
На данный момент известно 19 изотопов кюрия. Наиболее доступные из них — 242Cm, 244Cm являются ?-излучателями, но имеют гораздо меньшие, чем у изотопов америция, периоды полураспада. У этих изотопов почти отсутствует ?-излучение, но зато заметным являются спонтанное деление и связанное с ним испускание нейтронов. Более долгоживущие изотопы кюрия(245—248Cm, все ?-излучатели) образуются в виде смеси при облучении нейтронами плутония или америция. В этой смеси при не очень продолжительном облучении преобладает кюрий-246, а затем начинает накапливаться кюрий-248. Оба эти изотопа, особенно 248Cm, имеют большие периоды полураспада и гораздо более удобны для проведения химических исследований, чем 242Cm и 244Cm; однако они также обладают довольно большой скоростью спонтанного деления. Наиболее живущий изотоп кюрия — 247Cm — не образуется в больших количествах из-за сильного деления на тепловых нейтронах.
Для берклия известно 14 его изотопов с массовыми числами 238—252. Единственный доступный из них в больших количествах — 249Bk имеет сравнительно малый период полураспада (330 дней) и испускает в основном мягкие ?-частицы, неудобные для регистрации. У него имеется также слабое альфа-излучение (1,45?10?3 % по отношению к ?-излучению), которое иногда используется для определения этого изотопа. Известен долгоживущий изотоп берклия-247 с периодом полураспада 1380 лет, имеющий альфа-излучение, но пока он не получен в весовых количествах. Образование изотопа при нейтронном облучении плутония не происходит из-за ?-стабильности изотопов кюрия с массовым числом меньше 248.
Изотопы калифорния с массовыми числами 237—256 образуются в ядерном реакторе, как и другие. Изотоп калифорния-253 является ?-излучателем, а все остальные — ?-излучателями. Кроме того, изотопы с чётными массовыми числами (250Cf, 252Cf и 254Cf) характеризуются большой скоростью спонтанного деления, особенно изотоп калифорния-254, у которого 99,7 % распадов происходит путём спонтанного деления. Стоит отметить изотоп калифорния-249, который обладает довольно большим периодом полураспада (352 года) и слабым спонтанным делением. У этого изотопа имеется и сильное ?-излучение, которое может значительно облегчить его идентификацию. Изотоп 249Cf не получается в больших количествах в ядерном реакторе вследствие медленного ?-распада материнского изотопа 249Bk и большого сечения взаимодействия с нейтронами, однако он может быть накоплен в изотопически чистом виде как продукт ?-распада предварительно выделенного 249Bk. Калифорний, выделенный из облучённого в реакторе плутония, содержит в основном изотопы 250Cf и 252Cf (при большом интегральном потоке нейтронов преобладает 252Cf), и работа с ним затруднена из-за мощного нейтронного излучения.
Характеристики некоторых равновесных пар изотопов ТПЭ
Известно 16 изотопов изотопов эйнштейния с массовыми числами от 241 до 257. Наиболее доступным из его изотопов является 253Es — ?-излучатель с периодом полураспада 20,47 дней, имеющий относительное слабое ?-излучение и небольшую по сравнению с изотопами калифорния скорость спонтанного деления. При более длительном облучении в реакторе образуется также долгоживущий 254Es (T?=275,5 дней).
Из изотопов фермия известно 19 нуклидов с массовыми числами от 242—260. Изотопы 254Fm, 255Fm, 256Fm являются ?-излучателями с короткими периодами полураспада (часы) и поэтому могут быть выделены в весовых количествах. Но при более длительном и мощном облучении можно, по-видимому, ожидать накопления заметных количеств долгоживущего изотопа фермия-257 (T?=100 дней). Все изотопы фермия, в том числе и 257Fm, характеризуются очень большими скоростями спонтанного деления.
Для менделевия известно 15 нуклидов с массовыми числами от 245 до 260[13]. Все исследования свойств изотопов менделевия проводились с 256Md, который распадается главным образом путём электронного захвата (?-излучение ? 10 %) с периодом полураспада 77 минут. Известен долгоживущий изотоп 258Md (T?=53 дня), он также является альфа-излучателем. Оба эти изотопа получают из изотопов эйнштейния (соответственно 253Es и 255Es), поэтому возможность получения изотопов менделевия ограничивается количеством имеющегося эйнштейния.
Долгоживущие изотопы нобелия имеют малые периоды полураспада; по аналогии, все последующие после актиноидов элементы имеют все меньшие (местами) периоды полураспада. Для этого элемента известно 11 его нуклидов с массовыми числами от 250 до 260, и 262. Изучение химических свойств нобелия и лоуренсия проводились с изотопами 255No (T?=3 мин.) и 256Lr (T?=35 сек.). Наиболее долгоживущий 259No (Т??1,5 часа) синтезирован в 1970 году в городе Оук-Ридж, США.
Торий и уран имеют самую высокую распространённость среди актиноидов; их атомные кларки равны 3?10?4 % и 2?10?5 % соответственно. В земной коре уран встречается в виде минеральной формы уранинита — U3O8 (смоляная руда, урановая смолка), а также карнотита — KUO2VO4·3H2O, отенита — Ca(UO2)2(PO4)2·nH2O и др. Два последних минерала имеют жёлтый цвет. Уран содержится также почти во всех минеральных формах редкоземельных минералов (фергюсонит, самарскит, эвксенит и др.).
Уран в природе встречается в виде изотопов 238U (99,2739 %), 235U (0,7204 %) и 234U (0,0057 %). Из них 238U имеет наибольший период полураспада (T? = 4,51?109 лет).
Уран принадлежит к числу редких и рассеяных элементов. Содержание в земной коре урана составляет примерно 2?10?4 %. Общие запасы урана исчисляются миллионами тонн. Из минеральных форм урана известно около 200 минералов, большинство из них относится к оксидам переменного состава.
Наиболее богатыми минералами на торий являются торианит (ThO2), торит (ThSiO4), монацит, шералит ((Th, Ca, Ce)(PO4,SiO4)), торогумит (Th(SiO4)1?x(OH)4x). Торий, также как и уран, сопровождается с минеральными формами почти всех редкоземельных элементов. Богатые месторождения монацитовых песков находятся в Индии, Бразилии, Австралии, Африке, Канаде, США и на Цейлоне.
Начальное распространение актиния в земной коре был очень мало (атомный кларк 5?10?15 %). Подсчитано, что общее распространение актиния в земной коре составляет 2600 т, в то время как, например, содержание радияравно 40 млн. т. Актиний содержится в таких природных материалах как сульфидные, силикатные, кислородсодержащие минералы; в природной воде — в ещё меньших количествах, по сравнению с урановыми рудами. Содержание актиния в большинстве природных объектов соответствует изотопному равновесию материнских изотопов 235U. Повышенным содержанием данного элемента обладают такие минералы, как молибденит, халькопирит, касситерит, кварц, пиролюзит и др. Актиний характеризуется невысокой миграционной способностью и перемещением, то есть распространение актиния меньше по сравнению с ураном.
Более распространённым является протактиний, атомный кларк которого 10?12 %. Протактиний был найден в урановой руде в 1913 году К. Фаянсом и О. Герингом. Общее содержание протактиния в земной коре (литосфере) в соответствии с содержанием урана (изотопы протактиния образуются при распаде 235U) составляет 4,4?107 т. Содержание в горных породах вулканического происхождения составляет 0,8?10?6 г/т, а в железных метеоритах 0,02?10?6 г/т.
Период полураспада самого долгоживущего изотопа 237Np ничтожно мал по сравнению с возрастом Земли, поэтому в природных минералах нептуний практически не встречается. На Земле его нуклиды могут образоваться практически лишь с помощью ядерных реакций. Нептуний находится в минералах как промежуточный продукт распада других изотопов.
Наличие плутония в небольших количествах в минеральных формах урана было впервые установлено в 1942 году. Верхний предел распространённости на Земле 244Pu — самого долгоживущего из изотопов плутония — составляет 3?10?22 г/г. Известно, что настуран икарнотит, найденные в Канаде и в штате Колорадо, содержат небольшое количество ?-излучающего изотопа плутония 239Pu. Было определено содержание плутония в ряде урановых руд, с последующим выделением плутония из отходов производства 239Pu. Ни в одной из этих минеральных форм не было выделено другого изотопа плутония, кроме плутония-239. В образцах лунного грунта плутоний не был обнаружен.
Однако даже использование богатейших на плутоний урановых руд не сможет вытеснить искусственное получение данного элемента. На это указывает тот факт, что для выделения микрограммовых количеств плутония потребуется на каждый выделенный микрограмм плутония переработать 100 т рудного концентрата плутония.
В большинстве случаев для получения чистого вещества элементов применяют разложение химического соединения этого элемента, обычно путём реакции его оксида, фторида и т. д. с водородом. Однако этот метод неприменим к актиноидам, поскольку они встречаются очень редко в природе, и поэтому для их выделения применяются более сложные методы очистки соединений, а затем и получения элементов данной группы.
В 1899 г. М. Кюри обнаружила, что воздух вокруг соединений радия становится проводником электричества. Исследованиями процессов радиоактивного распада урана-238, тория-232 и урана-235 Р. Б. Оуэнс, У. Рамзай, Дж. Резерфорд и Ф. Дорн независимо друг от друга установили, что изотопы радия-226Ra ,224Ra ,223Ra в результате испускания -частиц превращаются в изотопы элемента с порядковым номером 86-радон(222Rn),торон (220Rn ). актинон(219Rn). В общем случае для этого элемента принято название радон по его наиболее долгоживущему изотопу 222 Rn с Т1/2 =3,8 дня. Благодаря тому, что уран, торий и радий широко распространены в природе( рудах, почве, воде) радон содержится в почве и земной атмосфере.
В настоящее время известно 23 изотопа радона с массовыми числами от 202 до 224. Основными методами получения искусственных изотопов радона являются реакции глубокого расщепления, протекающие при облучении ториевых мишеней протонами высоких энергий.
Определение молекулярной массы радона показало, что он является одноатомным газом.
Радон самый тяжелый элемент нулевой группы. Радон бесцветен, сжижается в фосфоресцирующую жидкость с температурой кипения -61,8 0 С, затвердевающую при -71 0 С. Твердый радон светится ярко-голубым цветом, который сравнивают с электрическим.
Исследования химических свойств радона показали, что радон и его изотопы являются химическими аналогами инертных газов. Его электронная конфигурация 5s25p65d106s26p6, т.е. его внешние электронные уровни полностью заполнены, что и определяет инертность радона. В то же время, несмотря на то, что радон принадлежит к группе инертных газов, он образует вполне определенные группы соединений. Так, радон образует клатратные соединения с водой, фенолом, толуолом и т. п. В клатратных соединениях радона связь осуществляется за счет ван-дер-ваальсовых сил.
Радон получают накоплением при распаде радия, находящегося в растворе в специальной вакуумной аппаратуре.
Исторически первым и наиболее распространенным методом является радиометрический метод определения радона по радиоактивности продуктов его распада. 222 Rn может быть определен и непосредственно по интенсивности собственного альфа- излучения. Удобным методом определения радона является его экстракция толуолом с последующим измерением активности толуольного раствора с помощью жидкостного сцинтилляционного счетчика.
Основная область применения радона - медицина. Радон применяют для получения искусственных радоновых ванн при лечении ревматизма, радикулита, сердечнососудистых, кожных и ряда других заболеваний.
Радон нашел также применение в методах неразрушающего контроля для определения утечки трубопроводов, для исследования скорости движения газов и т. п.
Так как радон чрезвычайно опасен при попадании внутрь организма, все процедуры желательно осуществлять в специальных условиях, предотвращающих возможность попадания его в дыхательную систему. Опасен не сам радон, а продукты его распада. Все исследователи, работавшие с твердым радоном, подчеркивают непрозрачность этого вещества. Причина непрозрачности- моментальное осаждение твердых продуктов распада радона, которые являются б-, в-,г - излучателями. В то же время лечебный эффект радона обусловлен не самим радоном, а благодаря налету на теле продуктов его распада.
Применительно к радону эпитет «самый» можно повторять многократно: самый тяжелый, самый редкий, самый дорогой из всех известных газов наЗемле.
Среди элементов, стоящих в конце периодической системы Д. И. Менделеева, есть такие, о которых многое слышали и знают неспециалисты, но есть и такие, о которых мало, что сможет сказать и специалист. К числу первых относятся, например, радий и радон. К числу вторых - их сосед по периодической системе - франций. В 1879 году Менделеев на основе созданной им периодической системы предсказал существование и описал свойства наиболее тяжелого щелочного элемента-экацезия.
Лишь в 1939 г. Маргарита Перей, ученица Марии Складовской-Кюри открыла элемент с порядковым номером 87, химически выделив его из продуктов распада ряда 235 U. Он образуется при б- распаде Ac. М. Перей назвала этот элемент в честь своей родины францием (Fr):
Из продуктов распада актиния, франций был выделен путем соосаждения с перхлоратом цезия. В природе франций в ничтожных количествах содержится во всех урановых рудах (1 атом Fr на 7,710 14 атомов 235 U или 310 18 атомов природного урана).
В астоящее время известно 27 изотопов франция с массовыми числами от 203 до 229, из них два изотопа с массовыми числами 223 и 224 встречаются в природе, являясь членами радиоактивных семейств 235 U и 232 Th. Из всех известных изотопов франция представляет интерес только 223 Fr, как наиболее долгоживущий (период полураспада 22 мин .).
Кроме выделения из продуктов распада актиния, 223 Fr получают путем облучения 226 Ra нейтронами по схеме:
226 Ra(n,) 227 Ra AcFr
Франций интересен по двум причинам: во-первых, это самый тяжелый и самый активный щелочной металл; во-вторых, франций можно считать самым неустойчивым из первых ста элементов периодической системы. Нейтральный атом франция в основном состоянии имеет электронную конфигурацию[Rn]7s1. Единственной степенью окисления франция является +1.
Франций не может быть выделен в весомых количествах, так как периоды полураспада всех известных в настоящее время его изотопов слишком малы. У самого долгоживущего изотопа франция- 223 Fr- период полураспада составляет всего 22 мин.
Согласно положению в периодической системе элементов, франций - один из самых электроположительных металлов. В химическом отношении франций - самый ближайший аналог цезия. Отсюда следует, что все характерные для цезия химические формы должны существовать и у франция. Большинство солей франция хорошо растворимо в воде. К трудно растворимым солям относятся перхлорат, хлороплатинат, пикратокобальтинитрит и некоторые другие соли, которые изоморфно соосаждаются с аналогичными солями цезия. Будучи самым активным щелочным металлом, франций проявляет пониженную способность к комплексообразованию и гидролизу.
Находясь в растворе в ультрамикроконцентрациях (10 -9 -10 -13 г), франций может легко «потеряться», адсорбируясь на стенках сосудов, на поверхности осадков, на возможных примесях.
Поскольку франций не может быть получен в весомых количествах, его физико-химические характеристики найдены расчетным путем.
Химические свойства франция изучены только радиохимическими методами с использованием цезия в качестве специфического носителя. Массы франция в этих опытах не превышают 10 -15 г (массовая активность 223 Fr составляет 1,7 ·10 15 Бк/мг). Достаточно сложной проблемой является отделение франция от специфического носителя цезия. В соответствии с положением в периодической системе, франций должен иметь более отрицательный стандартный потенциал, чем цезий. Поэтому он может быть выделен только на ртутном катоде.
Франций легко адсорбируется на ионообменных смолах КУ-1 и Дауэкс-50 (сульфокатионитах) из нейтральных или слабокислых растворов. С помощью этих смол франций легко отделяется от большинства химических элементов.
Применяют франций в медицине и биологии при изучении распределения щелочных металлов в организме. Фиксируется он в основном в злокачественных опухолях, что делает его перспективным в ранней диагностике сарком.
Элемент № 88 был открыт Марией и Пьером Кюри в 1898 г вслед за полонием в минерале, известном под названием урановой смолки. М. Кюри обнаружила, что интенсивность излучения смоляной руды в несколько раз сильнее, чем U3 O8. полученный из металлического урана. Кюри было предположено, что руда содержит неизвестное вещество с более интенсивным излучением, чем уран. Было обнаружено, что фракции содержащие сульфид висмута и сульфат бария, обладают радиоактивностью. Это подтверждало предположение, что новый элемент является аналогом бария. В дальнейшей работе с помощью дробной кристаллизации хлористого бария (более 10 000 ступеней), было выделено 90 мг хлорида радия высокой чистоты. Это позволило определить атомную массу радия и изучить его спектр. Новый химический элемент с порядковым номером 88 был назван супругами Кюри радием (radius-луч).
Таким образом, радий-226 является продуктом распада урана-238 В настоящее время известно 13 изотопов радия с массовыми числами от 213 до 230. Из них четыре встречаются в природе и являются членами естественных радиоактивных семейств. Наиболее долгоживущим и важным из природных изотопов радия является изотоп 226 Ra с периодом полураспада 1622 года. 226 Ra является - - излучателем и содержится во всех рудах урана. В 1 т урановой смоляной руды содержится около 400 мг радия. В верхнем слое Земной коры толщиной 1,6 км содержится 1,810 7 т 226 Ra. Довольно много радия в некоторых природных водах - до 10 -8 г/л. В мировом океане содержится около 2·10 4 т радия.
Свежеполученный металлический радий - белый блестящий металл, темнеющий на воздухе с Ткип.=1140 С 0 и Тпл.=960 С 0. Впервые металлический радий был получен М. Кюри и А. Дебьерном выделением на ртутном катоде при электролизе раствора RaCl2 с последующим разложением амальгамы радия в токе водорода при нагревании до 700 С 0 .
Радий типичный представитель щелочно-земельных металлов и является самым тяжелым металлом главной подгруппы 11 группы периодической системы. Нейтральный атом радия в основном состоянии имеет электронную конфигурацию [Rn]7s2. Единственной степенью окисления радия является +2. По своим химическим свойствам радий похож на барий, но химически более активен. Он энергично разлагает воду, давая гидроокись Ra(OH)2. более растворимую, чем Ва(ОН)2.
Наиболее важными соединениями радия являются его галогениды: хлорид и бромид. Хорошо растворим в воде хлорид, бромид, иодид, нитрат и сульфид радия, плохо растворимы карбонат, сульфат, хромат, оксалат.
Все соли радия и бария изоморфны. Все свежеприготовленные соли радия имеют белый цвет с характерным голубым свечением в темноте. За счет самопоглощения б- и в-частиц, испускаемых при радиоактивном распаде 226 Ra и его дочерних продуктов, каждый грамм 226 Ra выделяет около 550 Дж (130 кал) теплоты в час, поэтому температура препаратов радия всегда немного выше окружающей.
Химия радия в водных растворах исследована с использованием микроколичеств этого элемента из-за его большой массовой радиоактивности (радиоактивность1 г радия составляет 3,71010Бк ). Радий в растворах находится в виде ионов Ra 2+.
В ряду щелочно-земельных металлов радий проявляет наименьшую склонность к комплексообразованию и гидролизу.
Радий обладает большой склонностью к сорбции из растворов на поверхности стеклянной посуды, фильтровальной бумаги, что затрудняет определение его физико-химических констант (например, растворимость солей радия). Радий образует комплексы с лимонной, молочной и винной кислотами.
Основная проблема при выделении радия из урановых руд состоит в отделении его от больших количеств урана и продуктов распада радия. Кроме методов сокристаллизации с изоморфными солями бария и свинца, для выделения радия используется хроматографические и экстракционные методы. Перспективным для выделения радия является использование неорганических неспецифических сорбентов, таких как Al2 O3.
Радий сыграл огромную роль в исследовании строения атомного ядра, явления радиоактивности и становлении радиохимии и ядерной физики. Можно утверждать, что если бы 100 лет назад не был бы открыт элемент радий, то вряд ли прошлый век называли бы атомным. За открытие явления радиоактивности и радия Марии Склодовской - Кюри была дважды присужденаНобелевская премия (первый раз по физике-1903 г. второй - по химии-1911 г.).
Основные области применения радия обусловлены его - излучением (в методах неразрушающего контроля для определения дефектов литья, в толщиномерах, при разведке месторождений урана и т.д.).
Альфа- излучение радия позволяет использовать его для производства светящихся красок и для снятия статических зарядов.
В смеси с бериллием радий используют для изготовления нейтронных источников.
В медицин е радий используют как источник радона.
Радий обладает большой подвижностью в природе и довольно сильно может выщелачиваться из горных пород. Поэтому большинство урановых минералов теряет значительную часть радия (иногда эти потери составляют до 85%), который легко попадает в природные воды. Из естественных радиоактивных изотопов наибольшее биологическое значение имеет долгоживущий 226 Ra. Радий неравномерно распределен в различных участках биосферы. Накопление радия в органах и тканях растений подчиняется общим закономерностям поглощения минеральных веществ и зависит от вида растения и условий его произрастания. Как правило, в корнях и листьях травянистых растений радия больше, чем в стеблях и органах размножения; больше всего радия в коре и древесине. Среднее содержание радия в цветковых растениях 0,3-9,0·10 -11 кюри/кг, в морских водорослях 0,2-3,2·10 -11 кюри/кг.
В организм животных и человека поступает с пищей, в которой он постоянно присутствует (в пшенице 20-26·10 -15 г/г, в картофеле 67-125·10 -15 г/г, в мясе 8·10 -15 г/г), а также с питьевой водой. Суточное поступление в организм человека 226 Ra с пищей и водой составляет 2,3·10 -12 кюри, а потери с мочой и калом 0,8·10 -13 и 2,2·10 -12 кюри. Около 80% поступившего в организм радия (он близок по химические свойствам Са), накапливается в костной ткани. Содержание радия в организме человека зависит от района проживания и характера питания. Большие концентрации радий в организме вредно действуют на животных и человека, вызывая болезненные изменения в виде остеопороза, самопроизвольных переломов, опухолей. Содержание радия в почве свыше 1·10 -7 -10 -8 кюри/кг заметно угнетает рост и развитие
Радий обладает большой подвижностью в природе и довольно сильно может выщелачиваться из горных пород. Поэтому большинство урановых минералов теряет значительную часть радия (иногда эти потери составляют до 85%), который легко попадает в природные воды.
10.8.1 ОБЩИЕ СВОЙСТВА АКТИНОИДОВ
Актиноидами называют группу элементов 7-го периода с порядковыми номерами от 89 (актиний) до 103 (лоуренсий), подобную группе лантаноидов. В группу актиноидов входят: торий, протактиний, уран, нептуний, плутоний, америций, кюрий,берклий, калифорний, энштейний, фермий, менделеевий, нобелий, лоуренсий.
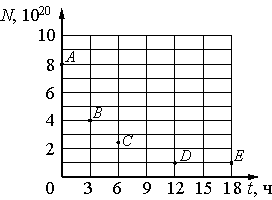
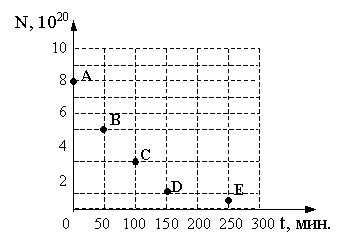
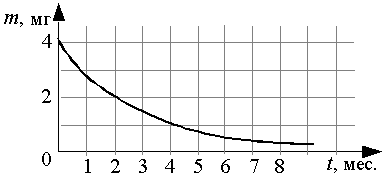
В таблице 9.1. представлены наиболее важные изотопы актиноидов:
Таблица 9.1. Наиболее важные изотопы актиноидов
В свою очередь отдельные группы актиноидов объединяют в подгруппы: все элементы следующие за ураном называют трансурановыми элементами, элементы, следующие за америцием, называют трансамерициевыми элементами и т.д.
В процессе рассмотрения химии тяжелых элементов - тория, протактиня, урана и трансурановых элементов Глен Сиборг в 1946 г. выдвинул актиноидную теорию. В соответствии с этой теорией элементы с порядковыми номерами 89-103 образуют 5f -семейство и по аналогии с лантаноидами размещаются в периодической системе в виде отдельной группы .
В настоящее время имеется много доказательств справедливости актиноидной гипотезы (электронные конфигурации атомов, спектры и магнитные свойства актиноидных и лантаноидных элементов). Согласно актиноидной теории Сиборга всего в слое 5 f может находиться 14 электронов. Следовательно,103-й элемент должен быть последним актиноидом, так как у него будут полностью застроены уровни 5f, 6s и 6p. С другой стороны, следует ожидать, что 104-й элемент будет находиться в состоянии 6d27s2, т.е. относиться к четвертой группе системы Менделеева, следовательно, по своим свойствам он должен быть похож на торий.
Рис. Глен Сиборг
По своему химическому поведению актиноиды занимают промежуточное положение между f - и d- элементами. Этим объясняется большое многообразие валентных состояний у актиноидов по сравнению с соответствующими лантаноидами. Последнее объясняет двойственность химического поведения легких актиноидов. По мере заполнения электронами 5f-подуровня относительная энергия 5f-электронов уменьшается и становится меньше энергии 6 d -подуровня. При этом уменьшается разнообразие валентных форм тяжелых актиноидов, которые все в большей степени проявляют свойства присущие лантаноидам. Особенно отчетливо своеобразие химических свойств проявляется у элементов от актиния до кюрия. Для элементов от урана до америция характерно наибольшее разнообразие степеней окисления.
Актиноиды в степени окисления +3 являются химическими аналогами лантаноидов, но обладают более сильно выраженной способностью к комплексообразованию.
Актиноиды в степени окислении +4 являются химическими аналогами тория и церия (1У) в большей степени, чем гафения и циркония. В степени окисления +4 эти элементы являются сильными комплексообразователями.
В степени окисления +5 все рассматриваемые элементы существуют в виде диоксиионов состава МеО.
В степени окисления +6 все рассматриваемые элементы находятся в виде диоксиионов состава МеО. Для урана эта степень является наиболее устойчивой. Степнь окисления +7 характерна для нептуния, плутония, америция.
С учетом вышеизложенного химические свойства актиния, тория и протактиния, урана будут рассмотрены отдельно, свойства более тяжелых актиноидов - по группам.
Основным источником получения природных изотопов элементов от актиния до урана включительно являются руды. содержащие уран и торий.
Методы искусственного получения актиноидов можно разделить на две группы.
Первая группа методов - облучение тория, урана и более тяжелых элементов нейтронами. Ядерные реакции, лежащие в основе этих методов, представляют собой многократно повторяющуюся реакцию радиационного захвата ядром нейтрона (n,) c последующим бета-распадом ( реакторный метод). Этим методом могут быть получены только изотопы с избытком нейтронов. Облучение нейтронами может осуществляться в ядерных реакторах с высокой интенсивностью потока нейтронов ( 10 13 - 10 15 н/см 2 ·с).
Получение трансурановых элементов в ядерном реакторе является единственным методом их промышленного производства.
Первая попытка синтеза трансурановых элементов относится к 1934 г. когда Э. Ферми провел серию работ по облучению урана медленными нейтронами. Однако выделить элементы 93 и 94 в этих исследованиях не удалось. Открытие первых шести трансурановых актиноидов впервые было осуществлено группой Глена Сиборга в Беркли (США) в период с 1940 по 1950 г. Они были получены облучением урана нейтронами.
238 U (n, ) 239 U 239 Np 239 Pu
С увеличением атомного номера и массового числа синтезируемого элемента резко уменьшается его выход. Самый тяжелый элемент, который может быть получен реакторным методом- Fm. Однако накопить этот изотоп в ядерном реакторе невозможно, из-за того. что время, необходимое для присоединения нейтрона по реакции
257 Fm (n, ) 258 Fm
значительно больше, чем период спонтанного деления образующегося продукта 258 Fm ( Т ? =3.8•10 -4 с).
Вторая группа методов получения трансурановых элементов состоит в облучении урана и более тяжелых элементов заряженными частицами с использованием ускорителей различных типов (ускорительный метод). Использование в качестве бомбардирующих ускоренных ионов дейтерия и гелия позволяет получить элементы вплоть до менделевия:
По своему химическому поведению актиноиды занимают промежуточное положение между элементами f - и d- серий. Этим объясняется большое многообразие валентных состояний у актиноидов по сравнению с соответствующими лантаноидами.
Основная степень окисления лантаноидов +3. Актиноиды благодаря меньшей энергии связи электронов на 5 f-уровне по сравнению с 4 f -электронами у лантаноидов и наличию у первых актиноидного ряда 6 d-электронов проявляют ряд степеней окисления. Степень окисления +3 не обнаружена у тория и не характерна для протактиния, мало устойчива для урана и нептуния, легко переходит в +4 для плутония. Начиная с америция, степнь окисления +3 является наиболее устойчивой. У калифорния и следующих за ним актиноидов появляется степень окисления +2, устойчивость которой растет от кюрия до менделевия. Для последнего она является наиболее устойчивой степенью окисления.
В таблице приведены степени окисления актиноидов в растворе
У лантаноидов в образовании связи участвуют d- и s -электроны. Переход с уровня 4f на 5d у них затруднен, требует значительной энергии, поэтому у лантаноидов степени окисления выше +3 осуществляются с трудом и лишь для некоторых лантаноидов. Переходы актиноидов из состояния окисления +3 и +4 в состояние окисления +5 и +6 затруднены по сравнению с переходами +3 в +4 и +5 в +6 вследствие изменения структуры иона, например,
Me 4+ + 2H2 OMeO+ 4H + + 2e -
Актиноиды - активные металлы, легко вступающие в реакции практически со всеми химическими элементами с образованием соответствующих соединений. Их химическая активность растет с увеличением атомного номера.
В растворе актиноиды образуют гидратированные ионы вида:
Ме 4+ (Th, U- Cf? Am, Cm и Cf только в виде комплексных ионов)
МеО или (МеО5 · nH2 O) 3 (Np, Pu, Am)
Ионы актиноидных элементов имеют небольшой размер и значительный заряд.
Ионные радиусы актиноидов, подобно лантаноидам, падают с ростом порядкового номера (табл.). Вследствие этого в водных растворах они гидролизованы. Не гидролизованные трех- и четырехзарядные ионы актиноидов существуют только в достаточно кислых растворах в отсутствие лигандов, имеющих большое сродство к катионам, практически в среде HClO4.
Они гидратированы и имеют состав Me(H2 O) и Me(H2 O). В других кислотах начинается комплексообразование. Гидролиз протекает по схеме
Аналогично протекает и комплексообразование
Таблица Ионные радиусы актиноидов
1899 году сотрудник Кюри Дебьерн в редкоземельной фракции отходов от переработки урановой смоляной руды обнаружил новое радиоактивное вещество. При химико-аналитическом разделении это радиоактивное вещество осаждалось аммиаком вместе с редкоземельными элементами и торием. Радиоактивность была приписана новому радиоактивному элементу, который был назван актинием ( излучающий).
Есть лишь одна причина, по которой элемент № 89 - актиний - интересует сегодня многих. Этот элемент, подобно лантану, оказался родоначальником большого семейства элементов - актиноидов. В это семейство входят все три кита ядерной энергетики - уран, плутоний и торий.
И так, согласно актиноидной теории Г. Сиборга, актиний - первый член семейства актиноидных элементов и, следовательно, налог лантана. Электронная конфигурация актиния в основном состоянии предполагается следующей: 6s6p66d17s2.
В настоящее время известно 24 изотопа актиния, три из них встречаются в природе(Ac ,Ac Ac). Остальные изотопы получены искусственным путем.
Радиоактивные свойства некоторых изотопов актиния:
232 Th(d,9n) 225 Pa(б)> 221 Ac
232 Th(d,8n) 226 Pa(б)> 222 Ac
232 Th(d,7n) 227 Pa(б)> 223 Ac
232 Th(d,6n) 228 Pa(б)> 224 Ac
232 Th(n,г) 233 Th(в - )> 233 Pa(в - ) 233 U(б)> 229 Th(б)> 225 Ra(в - )> 225 Ac
226 Ra(d,2n) 226 Ac
б или в - или электронный захват
235 U(б)> 231 Th(в - )> 231 Pa(б)> 227 Ac
232 Th(б)> 228 Ra(в - )> 228 Ac
228 Ra(n,г) 229 Ra(в - )> 229 Ac
232 Th(d,б) 230 Ac
232 Th(г,p) 231 Ac
232 Th(n,p) 232 Ac
Главный и долгоживущий изотоп актиния - Ac (период полураспада 22 года) является дочерним продуктом 235 U.
В урановых рудах актиний содержится в микроконцентрациях. В равновесии с 1 природного урана находится
10 -10 г Ac. Актиний может быть выделен из урановыхи ториевых руд путем осуществления кислотного разложения руды с последующим разделением и выделением продуктов распада урана и тория и отделения актиния от примесей с лантаноидами. От лантана актиний может быть отделен хроматографически на катионите в аммонийной форме или методом электрофореза .
Количество получающегося актиния настолько мало. что этот элемент входит в десятку редчайших элементов.
Из - за очень малого содержания актиния в рудах его предпочитают получать искусственным путем. обычно облучением радия мощным потоком нейтронов:
Именно этим путем получены чистые препараты актиния, на которых и были определены его основные свойства.
От радия актиний отделяют после растворения мишени в НСl довольно просто - экстракцией в раствор тиофенилкарбонила - трифторацетона в хлороформе при рН
3,6. Далее актиний осаждают в виде Ac2 (С2 О4 )3, растворяют в соляной кислоте и плавиковой кислотой переводят в AcF3. Затем в вакууме при 1200 0 С полученную соль восстанавливают металлическим литием до металла.
Элементарный актиний довольно тяжелый серебристо-белый металл, который легко окисляется на воздухе с образованием пленки оксида, предохраняющей металл от дальнейшей коррозии. Температура плавления актиния 1050 0 С.
Актиний находится в главной подгруппе третьей группы периодической системы. Основные сведения о химических свойствах актиния получены при исследовании образцов, содержащих микроколичества элемента. Электронная структура атома отвечает схеме 6d 1 7s 2. Его ближайшим химическим аналогом является лантан. У него, как и у лантана такая же валентность (+ 3), близкие атомные радиусы (1,87 нм у лантана и 2,03 нм у актиния), почти идентичное строение большинства соединений. Актиний подобно лантану химически активный элемент, быстро окисляющийся на воздухе. В то же время он имеет более основные свойства, чем лантан. В кислых растворах актиний присутствует в виде ионов. При рН>3 образуются коллоидные растворы. В микроконцентрациях актиний соосаждается гидроокисями иттрия, алюминия, железа.
Области применения изотопов актиния основаны на их ядерных характеристиках.
227 Ac в смеси с бериллием является источником нейтронов. Ac-Be-источники характеризуются малым выходом гамма - квантов и применяются в активационном анализе при определении Mn, Si, Al в рудах. Кроме того 227 Ac может использоваться в радиоизотопных источниках энергии.
225 Ac применяется для получения 213 Bi, а также в радио-иммунотерапии.
228 Ac применяют в качестве радиоактивного индикатора в химических исследованиях из-за его высокоэнергетического в-излучения. Смесь изотопов 228 Ac- 228 Ra используют в медицине как интенсивный источник г-излучения
Актиний относится к числу опасных радиоактивных ядов с высокой удельной б-активностью. Хотя абсорбция актиния из пищеварительного тракта по сравнению с радием сравнительно невелика, но наиболее важной особенностью актиния является его способность прочно удерживаться в организме в поверхностных слоях костной ткани. Первоначально актиний в значительной степени накапливается в печени, причём скорость его выведения из организма много больше скорости его радиоактивного распада. Кроме того, одним из дочерних продуктов его распада является очень опасный радон, защита от которого при работе с актинием является отдельной серьёзной задачей.
Элемент № 90 был открыт обычным химическим методом в 1828 г. Яном Берцелиусом и назван торием в честь древнескандинавского божества Тора. Радиоактивность тория была обнаружена в 1898 г. М. Кюри и одновременно с ней независимо немецким ученым Г. Шмидтом. Именно радиоактивность - основная причина нынешнего интереса к элементу № 90. Природный элемент практически представляет собой изотоп 232 Th. Торий-232 является родоначальником довольно большого семейства. Период полураспада тория-232 равен 1,39·10 10 лет.
Электронная конфигурация атома тория 6d27s2.
Основными источниками тория являются торийсодержащие минералы (монацит, ортит). Методы выделения тория предусматривают отделение его от сопутствующих редкоземельных элементов. В технологии для этой цели используется, в основном, экстракция тория ТБФ(трибутилфосфатом) после его отделения от основной массы редкоземельных элементов дробным осаждение менее растворимого сульфата тория.
В периодической системе 232 Th расположен в четвертой группе. Торий - серебристо-белый блестящий металл, стойкий к окислению в чистом виде, но обычно медленно тускнеющий до темного цвета с течением времени. Чистый торий - мягкий, очень гибкий и ковкий, с ним можно работать непосредственно (холодный прокат, горячая штамповка и т.п.), однако его протяжка затруднительна из-за низкого предела прочности на разрыв.
Порошок металлического тория пирофорен поэтому обращаться с ним нужно с осторожностью. При нагреве в воздухе он загорается и горит ярким белым светом. Это свойство тория было использовано в начале прошлого века для изготовления ториевых ламп.
Рис. Ториевая лампа
Торий медленно разрушается водой, но плохо растворяется в основных кислотах, за исключением соляной. Он малорастворим в серной и азотной кислотах.
При сильном нагреве торий взаимодействует с галогенами, серой и азотом. Он очень легко окисляется, поэтому его хранят под слоем керосина.
Химические свойства тория изучены методами классической химии. Торий способен проявлять степени окисления +4, +3, +2. наиболее устойчивой является +4. Ион Th +4 обладает большим зарядом, относительно малым радиусом и большим числом At At рироде.
Протактиний почти одновременно обнаружили О. Ган и Л. Мейтнер в Германии и Ф. Содди и Дж. Кренстон в Англии.
Рис. Лиза Мейтнер Рис. Фредерик Содди
Новый радиоактивный элемент был обнаружен при переработке минералов урана точно так же, как полоний, радий, актиний. Это был самый долгоживущий изотоп элемента № 91- протактиний-231 с периодом полураспада 35000 лет. Протактиний образуется в результате распада урана-235 по схеме:
В природе он находится в таких же количествах, как и радий ( 340 мг на 1 т урана). Поэтому протактиний принадлежит к числу наименее распространенных элементов на Земле. Кроме протактиния-231 в природе существует протактиний-234. Он также продукт распада урана, но период его полураспада очень мал.
Кроме этих двух изотопов протактиния, сейчас известны еще 17 изотопов с массовыми числами от 216 до 238 и периодами полураспада от долей секунды до нескольких дней. Изотоп (Т ? = 27 дней) обычно получают при нейтронном облучении тория по схеме:
Протактиний -самый неактиноидный актиноид. По своим свойствам он сходен с Nb, Ta, Zr, Hf, Ti. Это блестящий металл светло-серого цвета, покрытый на воздухе тонкой пленкой монооксида. По твердости протактиний близок к урану. Интересным свойством протактиния является его сверхпроводимость при 2? К. Электроння конфигурация атома протактиния 5f26d17s2.
Металлический протактиний может быть получен термическим разложением его галогенидов на вольфрамовой нити при высокой температуре и давлении 10 -3 - 10 -4 Па. Изучение химии протактиния осуществлялось методами классической химии с использованием долгоживущего изотопа. Протактиний легко реагирует с водородом при 250-300 о С, образуя гидрид PaH3. С иодом образует летучие иодиды сложного состава. Степени окисления протактиния +5, +4,+3,+2. из которых наиболее устойчивой является +5. Протактиний в степени окисления +5 в большей мере является аналогом тантала и ниобия. чем соседних актиноидов (урана, нептуния, плутония). Для протактиния (+5) в водных растворах характерна очень большая склонность к гидролизу и полимеризации с образованиемколлоидных форм. В ионной и молекулярной формах (+5) существует только в концентрированных растворах сильных минеральных кислот или в растворах, содержащих комплексующие агенты.
Основными методами выделения протактиния являются соосаждение, экстракция и хроматография. Наилучшими носителями являются фосфат циркония и гидроксид марганца(1У).
применяется как источник получения и по реакции (n,г)
(Т ? =73.6 ч) - используется как автономный изотопный источник тока, используется в качестве ядерного топлива.
Протактиний и его соединения чрезвычайно радиоактивны и радиотоксичны. Сравнительное количество протактиния в 250 миллионов раз токсичнее такого же количества синильной кислоты.
231 Pa в организме человека склонен накапливаться в почках и костях. ПДК для 231 Pa в воздухе рабочих помещений 5,6·10 ?4 Бк/м?. Максимальное безопасное количество протактиния при попадании в организм человека составляет 0.03 мккюри, что соответствует 0.5 мкг.
Уран- 92 -ой элемент Периодической системы Менделеева, последний и самый тяжелый из существующих в природе элементов. Этот элемент занимает в современной жизни особое место. Он сыграл, по словам Д.И. Менделеева выдающуюся роль в утверждении периодического закона.
В дальнейшем с ураном оказались связанными два важнейших открытия науки ХХ века, давшие толчок многочисленным исследованиям: радиоактивность и деление ядер .
Уран, главный элемент ядерной энергетики и сырье для получения другого главного энергетического элемента- плутония, причастен ко многим открытиям ХХ века. Уран помог раскрыть тайны атома, стал источником невиданной мощи. Он основа современной «алхимии», превращения элементов и получения новых. В нейтронных потоках урановых реакторов в наши дни тоннами накапливаются элементы, в десятки раз более ценные, чем золото.
Открыл уран немецкий химик Клапрот в 1789 г. выделив из саксонской смоляной руды черное металлоподобное веществ, и назвал его ураном. Более пятидесяти лет это вещество считалось металлом и только в 1841 г. францезский химик Пелиго доказал, что это окисел урана UO2. Прошло еще 55 лет и, в 1896 г. А. Беккерель обнаружил, благодаря урану, явление радиоактивности.
Природный уран состоит из трех изотопов: 238 U - 99,2739%, продукт его распада 234 U- 0,0057% и 235 U - 0,7204%. Первый и последний являются родоначальниками семейств естественных радиоактивных элементов урана (тип ядра по массе 4n+2) и 235 U (актиноурана) (4n+3). Их периоды полураспада равны соответственно 4,51.10 9 и 7,13.10 8 лет. С помощью циклотрона и ядерного реактора в настоящее время получено 11 искусственных радиоактивных изотопов и 1 изомер урана. Наиболее важный из них - 233 U (T1/2 = 1.62·10 5 лет), как и 235 U способен к цепной реакции деления, поэтому является ядерным горючим.
Уран довольно широко распространен в природе. По распространенности он занимает 38-е место.
Уран, наряду с первичными рудами магматического происхождения, образует вторичные осадочные рудные месторождения. Он содержится более чем в 100 различных минералах. Главные из них - окислы урана и смешанные соли ванадиевой, фосфорной, кремневой, мышьяковой, титановой и ниобиевой кислот. Наиболее важными первичными минералами промышленных месторождений являются уранинит и урановая смолка, а вторичным минералом - карнотит.
Рис. Уранинитовая руда
Уран - блестящий металл, напоминающий по внешнему виду сталь. Он обладает полиморфизмом. Он обладает относительно высокой температурой плавления 1132 0 С и кипения 4690 0 С. Электропроводность урана близка к электропроводности железа. Ниже 1 К уран становится сверхпроводником.
Химические свойства урана изучены методами классической химии. Электронная конфигурация атом урана 5f36d17s2.
Химические свойства урана довольно сложные. Химически уран очень активный металл. Быстро окисляясь на воздухе, он покрывается радужной пленкой оксида. Мелкий порошок урана самовоспламеняется на воздухе, он зажигается при температуре 150--175 °C, образуя U3 O8. При 1000 °C уран соединяется с азотом, образуя желтый нитрид урана. При сильном встряхивании металлические частицы урана начинают светиться. Вода способна разъедать металл, медленно при низкой температуре, и быстро при высокой, а также при мелком измельчении порошка урана.
Уран растворяется в соляной, азотной и других кислотах, но не взаимодействует со щелочами.
Уран вытесняет водород из неорганических кислот и солевых растворов таких металлов, как ртуть, серебро, медь, олово, платина и золото.
Степени окисления урана +3, +4, +5, +6. Ионы урана гидратированы и гидролизованы. Степень гидролиза и комплексообразования растет в ряду:
Наиболее устойчивое валентное состояние в водных растворах U 6+. Однако в нейтральной и кислой средах как настоящий амфотерный элемент уран образует двухзарядные катионы уранила UO; в щелочной-- анионы диураната UO. Образующиеся при этом соли полиуранаты малорастворимы. Так, прибавление едкого натра к раствору какой-либо соли уранила вызывает выпадение желто-бурого аморфного осадка диураната:
Образование нерастворимых диуранатов из солей уранила-- очень важная реакции, которой пользуются для перевода шестивалентного урана в осадок. Полиуранаты являются типичным примером образования неорганических полимеров. Характерной особенностью почти всех солей шестивалентного урана является способность давать растворимые комплексы (даже в щелочной среде) в присутствии избытка карбонатов, оксалатов, сульфатов щелочных металлов или аммония вследствие образования комплексных ионов.
Рис. Урановое (U 6+ ) стекло
Тетрахлорид урана UCl4 и диоксид урана UO2 -- примеры четырёхвалентного урана. Вещества, содержащие четырёхвалентный уран, обычно нестабильны и при длительном пребывании на воздухе обращаются в шестивалентные.
Все соли U +4 ярко-зеленого цвета. Четырехвалентный уран в кислотах более склонен к комплексообразованию, чем U 6+.
Выделение урана из природных объектов производится путем кислотного или карбонатного выщелачивания его после предварительного обогащения руды. Первое - дешевле, поскольку для извлечения урана используют серную кислоту. Но если в исходном сырье, как, например, в урановой смолке, уран находится в четырехвалентном состоянии, то этот способ неприменим: четырехвалентный уран в серной кислоте практически не растворяется. И либо нужно прибегнуть к щелочному выщелачиванию, либо предварительно окислять уран до шестивалентного состояния.
Окончательное извлечение урана осуществляется методами экстракции, ионного обмена и др. Методы ионного обмена и экстракции хороши тем, что позволяют достаточно полно извлекать уран из бедных растворов, в литре которых лишь десятые доли грамма элемента №92. После этих операций уран переводят в твердое состояние - в один из окислов или в тетрафторид UF4 .
Металлический уран в небольших количествах получается восстановлением U3 O8 магнием или натрием в атмосфере СО2. Промышленный способ получения металлического урана заключается в восстановлении UF4 кальцием или магнием.
Из всех известных изотопов урана наибольшее применение имеет изотоп урана 235U, в котором возможна самоподдерживающаяся цепная ядерная реакция. Поэтому этот изотоп используется как топливо в ядерных реакторах, а также в ядерном оружии (критическая масса около 50 кг). Возможные схемы вынужденного деления были рассмотрены более подробно в главе 6 (раздел 6.6.2).
Изотоп U238 способен делиться только под влиянием бомбардировки высокоэнергетическими нейтронами, эту его особенность используют для увеличения мощности термоядерного оружия (используются нейтроны, порождённые термоядерной реакцией). Изотоп U захватывает (радиационный захват) медленные нейтроны с образованием составного ядра U, которое распадается до основного состояния с испусканием одного или нескольких гамма- квантов, бета- частицы, протона или альфа- частицы:
Таким образом, U с одной стороны является ядом для цепной реакции. С другой стороны в результате радиационного захвата возможно воспроизводство ядерного горючего с образованием делящегося Pu. Pu используется, в основном, для производства ядерного оружия.
Если ядерный реактор работает на смеси природного Th с U при радиационном захвате нейтрона торием возможно получение 233 92 U:
Уран-233 является ядерным топливом для атомных электростанций и производства атомных бомб (критическая масса около 16 кг). Уран-233 также является наиболее перспективным топливом для газофазных ядерных ракетных двигателей.
В ядерных реакторах в качестве тепловыделяющих элементов (ТВЭЛов) могут использоваться чистый уран или его сплавы с алюминием, цирконием, хромом, цинком. В большинстве энергетических реакторов обычно применяют керамические сердечники из двуокиси урана (UO2 ), которые не деформируются в течение рабочего цикла выгорания топлива. Другое важное свойство этого соединения -- отсутствие реакции с водой, которая может привести в случае разгерметизации оболочки ТВЭЛа к попаданию радиоактивных элементов в теплоноситель. Также, к достоинствам диоксида урана можно отнести то, что его плотность близка плотности самого урана, что обеспечивает нужный поток нейтронов в активной зоне.
Рис. Тепловыделяющие элементы (ТВЭЛы)
Четверть века назад ядерные реакторы обычно называли атомными котлами, подчеркивая тем самым суть происходящих в них процессов: главное - это выделение энергии. Но если в обычных топках горючее полностью (или почти полностью) сгорает, то в ядерном реакторе все обстоит иначе. В рабочем цикле выгорает лишь незначительная доля урана: «протопить» реактор до полного выгорания ядерного горючего технически невозможно. Уран в реакторе постепенно «зашлаковывается» продуктами деления и в нем меньше становится урана-235. Цепная реакция неизбежно начинает глохнуть, и поддержать ее можно, только сменив твэлы. Поэтому старые твэлы снимают и отправляют на переработку: их растворяют в кислотах и извлекают уран из раствора методом экстракции. Уран легко образует экстрагируемые комплексы и переходит в органическую фазу, а осколки деления, от которых нужно избавиться, остаются в водном растворе.
Уран и его соединения токсичны. Особенно опасны аэрозоли урана и его соединений. Для аэрозолей растворимых в воде соединений урана ПДК в воздухе 0,015 мг/м?, для нерастворимых форм урана ПДК 0,075 мг/м?. При попадании в организм уран действует на все органы, являясь общеклеточным ядом. Молекулярный механизм действия урана связан с его способностью подавлять активность ферментов. В первую очередь поражаются почки. При хронической интоксикации возможны нарушения кроветворения и нервной системы. В микроколичествах (10 ?5 --10 ?8 %) обнаруживается в тканях растений, животных и человека. В наибольшей степени накапливается некоторыми грибами и водорослями. Соединения урана всасываются в желудочно-кишечном тракте (около 1 %), в легких -- 50 %. Основные депо в организме: селезёнка, почки, скелет, печень, лёгкие и бронхо-лёгочные лимфатические узлы. Содержание в органах и тканях человека и животных не превышает 10 ?7 г.