









Категория: Руководства
По данным исследования кадрового агентства «КАУС-Медицина», проведенного по итогам второго квартала 2013 г. максимальный уровень вознаграждения директора по качеству на фармпредприятии достигает 200 тыс. рублей в месяц, что сопоставимо с максимальным окладом руководителя отдела продаж фармацевтической компании.
При этом средний уровень зарплаты директоров по качеству колеблется в пределах 123 тыс. - 160 тыс. рублей (директора по продажам – от 120 тыс. до 170 тыс. рублей).
Менеджер по качеству на фармпредприятии может рассчитывать на оклад в 50 тыс. (минимум) – 90 тыс. рублей (максимум).
Зарплата технолога фармпроизводства варьируется от 40 тыс. (минимальный уровень) до 60 тыс. рублей (максимальный).
Химик-аналитик зарабатывает в фарминдустрии от 35 тыс. до 60 тыс. рублей в месяц.
С полным текстом статьи можно ознакомиться здесь: http://pharmpersonal.ru/publs/novosti-anonsy/novosti-rynka/zarplata-direktora-po-kachestvu-na-farmproizvodstve-sravnima-s-doxodom-direktora-po-prodazham.html
<*> Первую часть статьи см. в "Ремедиум" N 12, 2007 г.
Грамотно интегрированная система менеджмента становится основой для улучшения деятельности компании, позволяет успешно работать в будущем, связывает все заинтересованные стороны единой целью, и в конечном итоге компания эффективно функционирует в жесткой конкурентной среде.
ПОДХОДЫ К ПОСТРОЕНИЮ ИСМОчевидно, что одним из принципов интеграции различных систем менеджмента является построение некой базовой системы менеджмента и дополнение ее более специфичными процессами из соответствующих предметных областей. Из практики создания интегрированных систем различными компаниями известно, что в качестве основы лучше использовать стандарт ISO 9001:2000, описывающий требования к СМК, являющийся наиболее комплексным, охватывающий большую часть системы управления и в первую очередь такие его принципы, как процессный и системный подходы, лидерство руководителя и вовлечение работников. Реализация именно этих принципов позволит наилучшим образом обеспечить интегрирование отдельных стандартов в единую цельную систему. В зависимости от состояния фармкомпании, ее целей, уровня управления качеством, степени внедрения требований GMP, прежде всего, необходимо решить вопрос, как должна строиться базовая СМК.
ПЕРВЫЙ ПРИНЦИП ИНТЕГРАЦИИПринцип первый может использоваться, если система качества на предприятии не соответствует правилам GMR Система качества опирается на требования ISO 9001:2000, дополняется и усиливается отраслевыми требованиями GMP, т.е. строится базовая СМК, при необходимости учитываются требования ISO 22000:20005 (НАССР), после чего система может легко интегрироваться с ISO 14001, OHSAS 18001 и/или SA 8000 или с ISO 27001 и т.п. Возможно, такой подход назовут революционным, возможно, кто-то и не согласится с "второстепенной" ролью GMP при построении систем менеджмента. Но давайте сравним термины. Согласно ISO 9001:2000 система менеджмента качества - система менеджмента (п. 3.2.2 СМК) для руководства и управления организацией (п. 3.3.1) применительно к качеству (п. 3.1.1). Обеспечение качества - часть менеджмента качества (п. 3.2.8), направленная на создание уверенности, что требования (п. 3.1.2) к качеству будут выполнены. Соответственно, система менеджмента качества регулируется требованиями ISO 9001:2000, а ее составная часть: обеспечение качества, - правилами GMP (ГОСТ Р 52249-2004, Руководство 42-01-2001). То, что стандарт ISO 9001:2000 и правила GMP имеют единую идеологию и дополняют друг друга, подтверждается и таблицей.
Итак, почему же в данном случае за базовые требования не стоит брать правила GMP? Даже построив идеальную систему менеджмента, выполняющую все требования GMP, - за пределами такой системы остаются подразделения коммерческой службы (маркетинг, продвижение лекарственных препаратов, обратная связь с конечным потребителем), вопросы стратегического и оперативного планирования, вопросы обучения менеджеров, не связанных с производством и т.п. А ведь истинное достижение качества возможно только при совместных усилиях всех служб компании, их совместном желании и взаимопонимании.
ВТОРОЙ ПРИНЦИП ИНТЕГРАЦИИПринцип второй можно применить, если система управления качеством внедрена в соответствии с GMP. Построенная система качества (в соответствии с GMP) дополняется требованиями ISO 9001:2000, далее при необходимости она может быть дополнена требованиями ISO 22000:20005 (НАССР), после чего система может интегрироваться с ISO 14001, OHSAS 18001 и/или SA 8000, или ISO 27001 и др.
Оба принципа построения базовой системы в конечном итоге приводят к одинаковому результату. Однако при оценке усилий на построение базовой системы следует учитывать следующее мнение экспертов: если в компании внедрены требования GMP, т.е. функционирует управление качеством, то для интегрирования требований ISO необходимо приложить еще 30% усилий, если же система качества в соответствии с требованиями ISO, то для достижения соответствия требованиям GMP - 70% усилий.
Нельзя сказать, что система, построенная только в соответствии с требованиями GMP, не может эффективно функционировать. Может, но от внимания менеджеров будет ускользать огромный объем информации, необходимой для успешного и стабильного функционирования компании. Необходимо всю деятельность компании включить в систему управления, поэтому и нужна интегрированная система.
МЕХАНИЗМЫ РАЗРАБОТКИ ИНТЕГРИРОВАННЫХ СИСТЕМ МЕНЕДЖМЕНТАНезависимо от того, что положило начало построению СМК, требования GMP или ISO, в компании должна существовать базовая система, на которой в дальнейшем будет строиться вся интегрированная система. Необходимо обратить внимание на то, что ISO 9001:2000 предъявляет требования не к качеству продукции, а к системе менеджмента, которая призвана обеспечивать предсказуемый и стабильный уровень качества продукции, процесса производства и компании в целом.
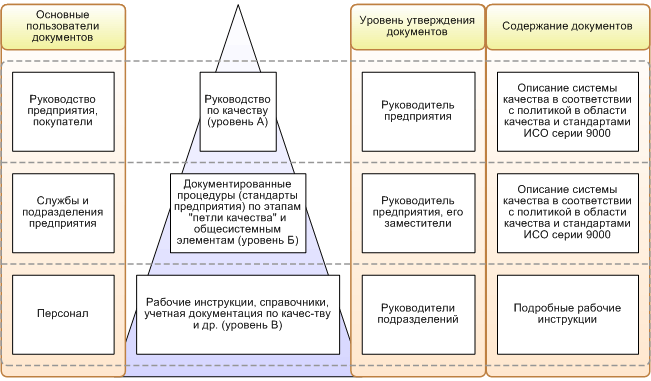
В ходе работы над созданием интегрированной системы менеджмента потребуется более широкий взгляд на понятие "качество". Классическое определение качества - степень, с которой совокупность собственных характеристик продукции соответствует требованиям. Говоря об интегрированной системе, термин качество следует трактовать как степень соответствия фактической работы организации тому, как эта работа была запланирована (в части соответствия технологиям, оперативным планам, стратегическим планам и т.д.). Это не противоречит классическому определению качества, поскольку требования всех заинтересованных сторон отражаются в том, как предприятие планирует собственную деятельность. Таким образом, любой процесс компании, любая деятельность автоматически попадает в систему менеджмента, и цель функционирования этой системы становится очевидной и затрагивает все аспекты управления компанией (финансовые, маркетинговые и т.д.), а понятия "система менеджмента качества" и просто "система менеджмента" становятся взаимозаменяемыми. Графически такая система представлена на рисунке 1.
Сравнительная характеристика требований GMP и ISO 9001¦ о ------------+ Управление доступом к информации ¦
¦ ¦ Управление угрозами и уязвимостью ¦
В результате такой интеграции получается цельная, прозрачная и эффективная система менеджмента, охватывающая деятельность всего предприятия - выпуск качественной и безопасной продукции, в щадящих для природы условиях и безопасной для персонала среде.
Как показал анализ, практическое создание интегрированных систем менеджмента осуществляется по одному из двух вариантов:
1. Создание аддитивных (от лат. additio - прибавление) моделей интегрированных систем, когда к системе качества, исполняющей роль базовой системы и использующей требования GMP (при необходимости и НАССР), последовательно добавляются система экологического менеджмента, система менеджмента в области охраны труда и профилактики профзаболеваний OHSAS, система менеджмента информационной безопасности и т.п.
2. Создание одновременно интегрируемых моделей, когда требования всех систем менеджмента объединяются в единый комплекс одновременно.
Несмотря на неоспоримые организационные и экономические преимущества второго варианта создания интегрированной системы, он встречается крайне редко, что обусловлено сложностью работ и необходимостью наличия персонала высокой квалификации. Исходя из практики, более приемлемой является аддитивная модель интегрирования международных систем менеджмента, хотя она требует больше времени на внедрение. Более детально рассмотрим именно механизм разработки интегрированной системы аддитивным способом.
Выше уже говорилось о построении базовой системы менеджмента качества (СМК) на основе ISO 9001 и GMP (два пути построения представлены выше).
Затем, приступая к интеграции с ISO 14001, в первую очередь необходимо определить экологические аспекты, адаптировать политику в сфере качества и экологического менеджмента в единый документ, детализировать готовность к аварийным ситуациям и реагирования на них, отработать систему обращения с отходами. Т.е. в результате потребуется разработка отдельных 5-7 специальных процедур и незначительные коррективы в общесистемные документированные процедуры (анализ со стороны руководства, корректирующие и предупреждающие действия). Аналогичный алгоритм интегрирования и у остальных систем менеджмента (OHSAS 18001, SA 8000, ISO 27001). По сути дела, речь идет о реализации процессного подхода в соответствии с требованиями стандарта ИСО 9001:2000.
Не возникнет проблем и со структурой процессов системы менеджмента компании. Изначально построив модель процессов по ISO 9001, интеграция с ISO 14001 добавляет лишь 3 вспомогательных процесса - "Экологический мониторинг", "Действия в аварийных ситуациях" и "Обращение с отходами", с OHSAS 18001 и SA 8000 - добавляют процесс "Менеджмент рисков" и позволяют интегрироваться в уже существующие процессы, а с ISO 27001 - добавляет всего один управляющий процесс "Информационная безопасность", также легко интегрируясь в другие процессы системы менеджмента.
Безусловно, в каждой компании свой подход к структуре процессов, однако стоит помнить и о том, что бездумное увеличение процессов, включаемое в структуру управления, не просто увеличивает расходы компании, но и приводит к потере приоритетов и управляемости в целом. При построении интегрированной системы нужно быть готовым к возможному изменению организационной структуры. Может появиться необходимость во введении должности директора по логистике, который станет заниматься не только традиционными вопросами материальных потоков на складах, но и вопросами информационных потоков в компании, операционного директора или же директора по совершенствованию, который методически обеспечит функционирование интегрированной системы и взаимодействия представителей высшего руководства от каждой из интегрируемых систем менеджмента.
Документирование интегрированной системы, подобно документированию любой из отдельных систем, предусматривает определение структуры и видов документов интегрированной системы, установление правил их разработки, идентификации и обращения. Зачастую оказывается, что достаточно лишь констатировать соответствие действующей системы документооборота и структуры документов требованиям интегрируемого стандарта. Возможная структура интегрированной системы менеджмента фармпредприятия приведена ни рисунке 2.
Рисунок 2. Структура интегрированной системы менеджмента фармпредприятия¦ ЗАПОЛНЯЕМЫЕ ФОРМЫ ЗАПИСЕЙ ¦
Не останавливаясь на рассмотрении структуры документации и конкретных документов интегрированной системы, отметим, что объем документации и степень ее детализации обычно варьируют в зависимости от масштаба компании, сложности и характера процессов, а также от компетентности персонала. При этом грамотно разработанная документация в интегрированной системе увеличивается лишь на 10-15% от первоначальной документации системы менеджмента качества. В процессе разработки интегрированной системы особая роль должна принадлежать топ-менеджменту компании. Приступая к разработке системы, высшему руководству необходимо четко себе представлять не только явные выгоды от выполнения этой работы, но и потенциальные риски, а также масштаб, сложность и продолжительность предстоящей работы. Важно оценить уровень компетентности своих специалистов для успешного выполнения этой задачи, определить целесообразность привлечения внешних консультантов и уровень обучения своих сотрудников. При этом исключительно важно предпринять меры, направленные на обеспечение психологической устойчивости персонала. В числе наиболее значимых мер, которые должны помочь преодолеть возможные негативные психологические явления в ходе работы, участниками которых становятся все без исключения сотрудники организации, может стать проведение широкой разъяснительной работы в части причин, целей, характера, сроков и последствий создания интегрированной системы (при этом следует избегать появления у сотрудников завышенных ожиданий), обеспечение благоприятных стартовых условий для выполнения задач, мониторинг и регулярный анализ хода работ, информирование о его результатах всего персонала посредством прямых контактов с сотрудниками.
На этапе официального внедрения важно добиться, чтобы разработанная интегрированная система заработала и вошла в режим стабильного функционирования, а не создавалась, как "мертвые" тома документации для формального получения сертификатов. При этом первостепенную роль начинают играть самоинспекции (внутренние аудиты). Их главной задачей становится проверка степени практического выполнения требований, установленных в документах интегрированной системы. Для решения этой задачи необходимо адаптировать рекомендации ISO 19011 ко всей деятельности, охватываемой интегрированной системой компании.
При применении такого подхода разрыв между началом работ по внедрению одной системы и началом внедрения следующей может составлять от полугода до нескольких лет. Необходимо ли официально сертифицировать интегрированную систему? Однозначного ответа нет, однако считаем, что сертификацию внедренной интегрированной системы следует рассматривать как логическое завершение работ по ее созданию. Нельзя не учитывать того, что успешная сертификация, как правило, вызывает эмоциональный подъем в коллективе от качественно выполненной сложной работы, повышает лояльность работников к компании.
Сертифицировать интегрированную систему может один или несколько органов сертификации путем последовательной сертификации входящих в нее систем менеджмента. Однако наиболее предпочтителен для организации вариант сертификации интегрированной системы в целом одним органом. При этом важно отметить, что даже сегодня не каждый Орган сертификации психологически готов провести цельную сертификацию интегрированной системы - то и дело возникают призывы "Вы для нас разделите документацию!", но скорее это связано с квалификацией отдельных аудиторов, и комментировать это сложно. В заключение хочется отметить следующее:
1. Создание интегрированной системы - трудоемкий инновационный проект, который направлен на повышение эффективности и устойчивости менеджмента компании.
2. Ожидаемая результативность создания интегрированной системы может быть достигнута лишь в случае грамотного управления этим проектом, где ключевая роль должна принадлежать топ-менеджерам компании.
3. Интегрированная система требует первоначального построения некой базовой СМК на основе требований ISO 9001:2000, которые дополняются и усиливаются отраслевыми требованиями GMP или наоборот, а при необходимости и требованиями ISO 22000:20005 (НАССР), после чего система может легко интегрироваться с ISO 14001, OHSAS 18001 и/или SA 8000, или же с ISO 27001.
4. В разработке интегрированной системы следует избегать механического объединения элементов международных стандартов, отвечая на один лишь вопрос "Требованиям какого из пунктов стандарта соответствует определенное действие?", что может привести к формальному и поверхностному, а вследствие этого неэффективному внедрению системы.
5. Грамотно интегрированная система незначительно увеличит стандартную структуру документации системы менеджмента.
Главное, важно помнить, что совершенствование системы менеджмента не может быть завершенным. Система менеджмента открыта к новым задачам и меняющимся условиям, а результатом является устойчивость и динамичное развитие компании.
Эксперт по системам
На предприятии создана и функционирует система управления и обеспечения качества, определена политика и цели в области обеспечения качества:
В мае 2011 г. производство лекарственных средств в твердых желатиновых капсулах предприятия сертифицировано на соответствие требованиям Надлежащей производственной практики (GMP) по ТКП 030-2006 и СТБ 1435-2004. Ведется подготовка к сертификации на соответствие GMP производств ЛС в таблетках, пакетах «Саше» и банках.
Для обеспечения соответствия производства и продукции требованиям нормативных документов и стандартов GMP, на предприятии ежегодно планируются и выполняются мероприятия, направленные на контроль функционирования системы обеспечения и управления качеством, реализацию политики в области качества:
Контроль функционирования системы обеспечения и управления качеством, реализации политики в области качества осуществляет отдел обеспечения качества.
Заместитель директора по качеству осуществляет общее руководство в области обеспечения и управления качеством; в качестве Уполномоченного лица разрешает выпуск серии лекарственного средства в реализацию. На дистрибьюторский склад (склад готовой продукции) перевозятся только лекарственные средства, разрешенные на сдачу на склад для реализации.
Заместитель директора по производству, технолог, заведующий складом, специалисты отдела технического обеспечения осуществляют деятельность в области качества в структурных подразделениях.
Отдел контроля качества осуществляет контроль качества и оценку исходных и упаковочных материалов, промежуточной продукции, готовой продукции, проводит мониторинг производственной среды. От каждой серии готовых лекарственных средств отбираются образцы, которые хранят для повторения, при необходимости, испытаний продукции.
Разработаны процедуры и спецификации. определяющие методы испытаний и параметры контроля процессов, сырья, материалов, полупродуктов и готовой продукции в соответствии с действующей нормативной документацией. Разработаны процедуры, определяющие порядок управления документацией, требования к проведению валидаций, организации обучения персонала, оценки поставщиков, проведению аудитов (самоинспекций), проверки досье на серию и выдачи разрешений на выпуск готовой продукции, контроля изменений, работы с рекламациями и несоответствующей продукцией.
Аудиты проводятся с целью проверки производства, контроля, хранения сырья, материалов, продукции на соответствие требованиям GMP. Программа аудитов предусматривает проверку всех элементов системы качества не реже 1 раза в год.
Потребность в обучении персонала определяется с учетом установленной периодичности обучения, планируемых изменений в технологическом процессе, планов освоения новой продукции, необходимости освоения работниками новых профессий или выполнения новых операций, изменений в документации, результатов внутренних и внешних аудитов.
Определена концепция предприятия в области валидации (квалификации, аттестации). Квалификация оборудования проводится силами предприятия и сторонними организациями.
Целью валидации является регулярный контроль предписанных параметров, проверка работы производственного оборудования и процессов для получения доказательств соответствия требованиям к чистым помещениям, оборудованию, надежности технологических процессов и соответствия выпускаемых лекарственных средств.
Валидации (аттестации) подвергаются: оборудование, системы водо - и воздухоподготовки, процессы очистки оборудования, основные технологические процессы по производству и упаковыванию лекарственных средств.
При внесении существенных изменений в процессы, включая изменения оборудования или сырья и упаковочных материалов, которые могут повлиять на качество продукции, проводятся внеплановые валидации.
Ответственность за осуществление контроля и координации работ по рекламациям несет заместитель директора по качеству (Уполномоченное лицо).
На предприятии осуществляется контроль эффективности, безопасности и качества лекарственных средств. В соответствии с установленными процедурами и законодательными требованиями проводятся:

Информация взята с официального сайта: academpharm.by
СИСТЕМ МЕНЕДЖМЕНТА ФАРМПРЕДПРИЯТИЯ (II ЧАСТЬ) <*>
<*> Первую часть статьи см. в "Ремедиум" N 12, 2007 г.
Грамотно интегрированная система менеджмента становится основой для улучшения деятельности компании, позволяет успешно работать в будущем, связывает все заинтересованные стороны единой целью, и в конечном итоге компания эффективно функционирует в жесткой конкурентной среде.
ПОДХОДЫ К ПОСТРОЕНИЮ ИСМ
Очевидно, что одним из принципов интеграции различных систем менеджмента является построение некой базовой системы менеджмента и дополнение ее более специфичными процессами из соответствующих предметных областей. Из практики создания интегрированных систем различными компаниями известно, что в качестве основы лучше использовать стандарт ISO 9001:2000, описывающий требования к СМК, являющийся наиболее комплексным, охватывающий большую часть системы управления и в первую очередь такие его принципы, как процессный и системный подходы, лидерство руководителя и вовлечение работников. Реализация именно этих принципов позволит наилучшим образом обеспечить интегрирование отдельных стандартов в единую цельную систему. В зависимости от состояния фармкомпании, ее целей, уровня управления качеством, степени внедрения требований GMP, прежде всего, необходимо решить вопрос, как должна строиться базовая СМК.
ПЕРВЫЙ ПРИНЦИП ИНТЕГРАЦИИ
Принцип первый может использоваться, если система качества на предприятии не соответствует правилам GMR Система качества опирается на требования ISO 9001:2000, дополняется и усиливается отраслевыми требованиями GMP, т.е. строится базовая СМК, при необходимости учитываются требования ISO 22000:20005 (НАССР), после чего система может легко интегрироваться с ISO 14001, OHSAS 18001 и/или SA 8000 или с ISO 27001 и т.п. Возможно, такой подход назовут революционным, возможно, кто-то и не согласится с "второстепенной" ролью GMP при построении систем менеджмента. Но давайте сравним термины. Согласно ISO 9001:2000 система менеджмента качества - система менеджмента (п. 3.2.2 СМК) для руководства и управления организацией (п. 3.3.1) применительно к качеству (п. 3.1.1). Обеспечение качества - часть менеджмента качества (п. 3.2.8), направленная на создание уверенности, что требования (п. 3.1.2) к качеству будут выполнены. Соответственно, система менеджмента качества регулируется требованиями ISO 9001:2000, а ее составная часть: обеспечение качества, - правилами GMP (ГОСТ Р 52249-2004, Руководство 42-01-2001). То, что стандарт ISO 9001:2000 и правила GMP имеют единую идеологию и дополняют друг друга, подтверждается и таблицей.
Итак, почему же в данном случае за базовые требования не стоит брать правила GMP? Даже построив идеальную систему менеджмента, выполняющую все требования GMP, - за пределами такой системы остаются подразделения коммерческой службы (маркетинг, продвижение лекарственных препаратов, обратная связь с конечным потребителем), вопросы стратегического и оперативного планирования, вопросы обучения менеджеров, не связанных с производством и т.п. А ведь истинное достижение качества возможно только при совместных усилиях всех служб компании, их совместном желании и взаимопонимании.
ВТОРОЙ ПРИНЦИП ИНТЕГРАЦИИ
Принцип второй можно применить, если система управления качеством внедрена в соответствии с GMP. Построенная система качества (в соответствии с GMP) дополняется требованиями ISO 9001:2000, далее при необходимости она может быть дополнена требованиями ISO 22000:20005 (НАССР), после чего система может интегрироваться с ISO 14001, OHSAS 18001 и/или SA 8000, или ISO 27001 и др.
Оба принципа построения базовой системы в конечном итоге приводят к одинаковому результату. Однако при оценке усилий на построение базовой системы следует учитывать следующее мнение экспертов: если в компании внедрены требования GMP, т.е. функционирует управление качеством, то для интегрирования требований ISO необходимо приложить еще 30% усилий, если же система качества в соответствии с требованиями ISO, то для достижения соответствия требованиям GMP - 70% усилий.
Нельзя сказать, что система, построенная только в соответствии с требованиями GMP, не может эффективно функционировать. Может, но от внимания менеджеров будет ускользать огромный объем информации, необходимой для успешного и стабильного функционирования компании. Необходимо всю деятельность компании включить в систему управления, поэтому и нужна интегрированная система.
МЕХАНИЗМЫ РАЗРАБОТКИ ИНТЕГРИРОВАННЫХ
Независимо от того, что положило начало построению СМК, требования GMP или ISO, в компании должна существовать базовая система, на которой в дальнейшем будет строиться вся интегрированная система. Необходимо обратить внимание на то, что ISO 9001:2000 предъявляет требования не к качеству продукции, а к системе менеджмента, которая призвана обеспечивать предсказуемый и стабильный уровень качества продукции, процесса производства и компании в целом.
В ходе работы над созданием интегрированной системы менеджмента потребуется более широкий взгляд на понятие "качество". Классическое определение качества - степень, с которой совокупность собственных характеристик продукции соответствует требованиям. Говоря об интегрированной системе, термин качество следует трактовать как степень соответствия фактической работы организации тому, как эта работа была запланирована (в части соответствия технологиям, оперативным планам, стратегическим планам и т.д.). Это не противоречит классическому определению качества, поскольку требования всех заинтересованных сторон отражаются в том, как предприятие планирует собственную деятельность. Таким образом, любой процесс компании, любая деятельность автоматически попадает в систему менеджмента, и цель функционирования этой системы становится очевидной и затрагивает все аспекты управления компанией (финансовые, маркетинговые и т.д.), а понятия "система менеджмента качества" и просто "система менеджмента" становятся взаимозаменяемыми. Графически такая система представлена на рисунке 1.
Сравнительная характеристика требований GMP и ISO 9001
Рисунок 1. Система менеджмента качества фармкомпании
В результате такой интеграции получается цельная, прозрачная и эффективная система менеджмента, охватывающая деятельность всего предприятия - выпуск качественной и безопасной продукции, в щадящих для природы условиях и безопасной для персонала среде.
Как показал анализ, практическое создание интегрированных систем менеджмента осуществляется по одному из двух вариантов:
1. Создание аддитивных (от лат. additio - прибавление) моделей интегрированных систем, когда к системе качества, исполняющей роль базовой системы и использующей требования GMP (при необходимости и НАССР), последовательно добавляются система экологического менеджмента, система менеджмента в области охраны труда и профилактики профзаболеваний OHSAS, система менеджмента информационной безопасности и т.п.
2. Создание одновременно интегрируемых моделей, когда требования всех систем менеджмента объединяются в единый комплекс одновременно.
Несмотря на неоспоримые организационные и экономические преимущества второго варианта создания интегрированной системы, он встречается крайне редко, что обусловлено сложностью работ и необходимостью наличия персонала высокой квалификации. Исходя из практики, более приемлемой является аддитивная модель интегрирования международных систем менеджмента, хотя она требует больше времени на внедрение. Более детально рассмотрим именно механизм разработки интегрированной системы аддитивным способом.
Выше уже говорилось о построении базовой системы менеджмента качества (СМК) на основе ISO 9001 и GMP (два пути построения представлены выше).
Затем, приступая к интеграции с ISO 14001, в первую очередь необходимо определить экологические аспекты, адаптировать политику в сфере качества и экологического менеджмента в единый документ, детализировать готовность к аварийным ситуациям и реагирования на них, отработать систему обращения с отходами. Т.е. в результате потребуется разработка отдельных 5-7 специальных процедур и незначительные коррективы в общесистемные документированные процедуры (анализ со стороны руководства, корректирующие и предупреждающие действия). Аналогичный алгоритм интегрирования и у остальных систем менеджмента (OHSAS 18001, SA 8000, ISO 27001). По сути дела, речь идет о реализации процессного подхода в соответствии с требованиями стандарта ИСО 9001:2000.
Не возникнет проблем и со структурой процессов системы менеджмента компании. Изначально построив модель процессов по ISO 9001, интеграция с ISO 14001 добавляет лишь 3 вспомогательных процесса - "Экологический мониторинг", "Действия в аварийных ситуациях" и "Обращение с отходами", с OHSAS 18001 и SA 8000 - добавляют процесс "Менеджмент рисков" и позволяют интегрироваться в уже существующие процессы, а с ISO 27001 - добавляет всего один управляющий процесс "Информационная безопасность", также легко интегрируясь в другие процессы системы менеджмента.
Безусловно, в каждой компании свой подход к структуре процессов, однако стоит помнить и о том, что бездумное увеличение процессов, включаемое в структуру управления, не просто увеличивает расходы компании, но и приводит к потере приоритетов и управляемости в целом. При построении интегрированной системы нужно быть готовым к возможному изменению организационной структуры. Может появиться необходимость во введении должности директора по логистике, который станет заниматься не только традиционными вопросами материальных потоков на складах, но и вопросами информационных потоков в компании, операционного директора или же директора по совершенствованию, который методически обеспечит функционирование интегрированной системы и взаимодействия представителей высшего руководства от каждой из интегрируемых систем менеджмента.
Документирование интегрированной системы, подобно документированию любой из отдельных систем, предусматривает определение структуры и видов документов интегрированной системы, установление правил их разработки, идентификации и обращения. Зачастую оказывается, что достаточно лишь констатировать соответствие действующей системы документооборота и структуры документов требованиям интегрируемого стандарта. Возможная структура интегрированной системы менеджмента фармпредприятия приведена ни рисунке 2.
Рисунок 2. Структура интегрированной системы
Не останавливаясь на рассмотрении структуры документации и конкретных документов интегрированной системы, отметим, что объем документации и степень ее детализации обычно варьируют в зависимости от масштаба компании, сложности и характера процессов, а также от компетентности персонала. При этом грамотно разработанная документация в интегрированной системе увеличивается лишь на 10-15% от первоначальной документации системы менеджмента качества. В процессе разработки интегрированной системы особая роль должна принадлежать топ-менеджменту компании. Приступая к разработке системы, высшему руководству необходимо четко себе представлять не только явные выгоды от выполнения этой работы, но и потенциальные риски, а также масштаб, сложность и продолжительность предстоящей работы. Важно оценить уровень компетентности своих специалистов для успешного выполнения этой задачи, определить целесообразность привлечения внешних консультантов и уровень обучения своих сотрудников. При этом исключительно важно предпринять меры, направленные на обеспечение психологической устойчивости персонала. В числе наиболее значимых мер, которые должны помочь преодолеть возможные негативные психологические явления в ходе работы, участниками которых становятся все без исключения сотрудники организации, может стать проведение широкой разъяснительной работы в части причин, целей, характера, сроков и последствий создания интегрированной системы (при этом следует избегать появления у сотрудников завышенных ожиданий), обеспечение благоприятных стартовых условий для выполнения задач, мониторинг и регулярный анализ хода работ, информирование о его результатах всего персонала посредством прямых контактов с сотрудниками.
На этапе официального внедрения важно добиться, чтобы разработанная интегрированная система заработала и вошла в режим стабильного функционирования, а не создавалась, как "мертвые" тома документации для формального получения сертификатов. При этом первостепенную роль начинают играть самоинспекции (внутренние аудиты). Их главной задачей становится проверка степени практического выполнения требований, установленных в документах интегрированной системы. Для решения этой задачи необходимо адаптировать рекомендации ISO 19011 ко всей деятельности, охватываемой интегрированной системой компании.
При применении такого подхода разрыв между началом работ по внедрению одной системы и началом внедрения следующей может составлять от полугода до нескольких лет. Необходимо ли официально сертифицировать интегрированную систему? Однозначного ответа нет, однако считаем, что сертификацию внедренной интегрированной системы следует рассматривать как логическое завершение работ по ее созданию. Нельзя не учитывать того, что успешная сертификация, как правило, вызывает эмоциональный подъем в коллективе от качественно выполненной сложной работы, повышает лояльность работников к компании.
Сертифицировать интегрированную систему может один или несколько органов сертификации путем последовательной сертификации входящих в нее систем менеджмента. Однако наиболее предпочтителен для организации вариант сертификации интегрированной системы в целом одним органом. При этом важно отметить, что даже сегодня не каждый Орган сертификации психологически готов провести цельную сертификацию интегрированной системы - то и дело возникают призывы "Вы для нас разделите документацию!", но скорее это связано с квалификацией отдельных аудиторов, и комментировать это сложно. В заключение хочется отметить следующее:
1. Создание интегрированной системы - трудоемкий инновационный проект, который направлен на повышение эффективности и устойчивости менеджмента компании.
2. Ожидаемая результативность создания интегрированной системы может быть достигнута лишь в случае грамотного управления этим проектом, где ключевая роль должна принадлежать топ-менеджерам компании.
3. Интегрированная система требует первоначального построения некой базовой СМК на основе требований ISO 9001:2000, которые дополняются и усиливаются отраслевыми требованиями GMP или наоборот, а при необходимости и требованиями ISO 22000:20005 (НАССР), после чего система может легко интегрироваться с ISO 14001, OHSAS 18001 и/или SA 8000, или же с ISO 27001.
4. В разработке интегрированной системы следует избегать механического объединения элементов международных стандартов, отвечая на один лишь вопрос "Требованиям какого из пунктов стандарта соответствует определенное действие?", что может привести к формальному и поверхностному, а вследствие этого неэффективному внедрению системы.
5. Грамотно интегрированная система незначительно увеличит стандартную структуру документации системы менеджмента.
Главное, важно помнить, что совершенствование системы менеджмента не может быть завершенным. Система менеджмента открыта к новым задачам и меняющимся условиям, а результатом является устойчивость и динамичное развитие компании.
Эксперт по системам