








Категория: Инструкции
Фармакологическая группа: специфические иммунодепрессивные препараты; антагонисты рецепторов интерлейкина-2; моноклональные антитела
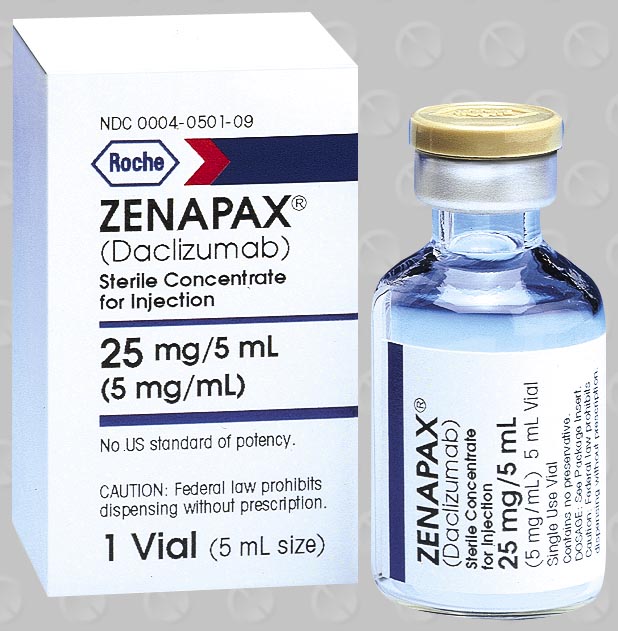
Торговые наименования: Зенапакс
Правовой статус: отпускается только по рецепту (США)
Применение: внутривенное
Период полураспада: 20 дней (11-38 дней)
Формула: C6332H9808N1678O1989S42
Мол. масса: 142,612.1 г / моль
Даклизумаб (торговая марка Zenapax) – это терапевтическое гуманизированное моноклональное антитело. Он используется для предотвращения отторжения при трансплантации органов, особенно при пересадке почек. Препарат также исследуется как средство для лечения рассеянного склероза. Даклизумаб действует путем привязки к CD25, альфа-субъединице IL-2 рецептора Т-клеток. Препарат продается в США, и не выпускается в Европе.
Даклизумаб принимается многократно, первая доза за 1 час до операции по трансплантации, и следующие 5 доз - с интервалом в две недели после трансплантации. Это насыщает рецепторы и предотвращает активацию Т-клеток, и таким образом предотвращает образование антител против трансплантата. Как аналогичный ему препарат базиликсимаб, даклизумаб снижает частоту и тяжесть острого отторжения при трансплантации почек без увеличения частоты оппортунистических инфекций. Даклизумаб также может быть использоваться совместно с ингибитором кальциневрина (циклоспорином или такролимусом) на ранней стадии после трансплантации почки, когда почка восстанавливается и является уязвимой к токсичности ингибитора кальцинейрина. Препарат эффективен при трансплантации донорской почки. В Соединенном Королевстве, Национальный Институт Здравоохранения и Клинического Мастерства (NICE) рекомендует использование препарата для всех реципиентов почечного трансплантата.
Рассеянный склерозВ 2006 году началась вторая фаза клинических испытаний препарата в качестве возможного средства для лечения рассеянного склероза (РС), которая закончилась в 2007 году. Участниками были девять пациентов с рассеянным склерозом, на которых не действовал интерферон. Была продемонстрирована эффективность Даклизумаба в снижении повреждений и улучшении клинических показателей. По состоянию на сентябрь 2013 года, препарат находится в III фазе испытаний для этого показания.
Аутоиммунные заболеванияДаклизумаб также используется для замедления прогрессирования аутоиммунных заболеваний, в частности, хориоретинопатии в виде выстрела в птицу.
Побочные эффектыОбщие побочные эффекты с частотой не менее 10% включают бессонницу, тремор, головную боль, артериальную гипертензию, одышку, побочные эффекты желудочно-кишечного тракта и отеки. В редких случаях препарат может вызывать серьезную анафилаксию.
ПротивопоказанияДаклизумаб нельзя применять кормящим женщинам.
Даклизумаб был разработан в компании PDL Biopharma, опираясь на исследования, проведенные в Национальном Институте Здоровья. С декабря 1997 года он поступает в продажу от Hoffmann-La Roche в США. В апреле 2008 года Хоффманн-Ля Рош подала заявку на снятие разрешения на продажу препарата в ЕС по коммерческим причинам. По данным компании, спрос на препарат на рынке уменьшился. С использованием препарата не было связано никаких проблем безопасности. По состоянию на январь 2009 года, разрешение на продажу препарата было снято, и продукт был полностью изъят с рынка.
ДоступностьДаклизумаб (Зенапакс) применяется в целях профилактики острого отторжения после трансплантации почек (в составе комбинированной терапии, включающей циклоспорин и кортикостероиды).
Фармакотерапевтическая группа L04АC01-селективные иммуносупрессивные средства.
Основная Фармакологическое действие: рекомбинированное гуманизированные а /т (антитело) IgG1 (анти-Тас), действующие как антагонисты рецепторов интерлейкину-2 (ИЛ-2), с высокой специфичностью связывается с альфа-субъединицей (Тас) высокоаффинного рецепторного комплекса ИЛ-2 (который экспрессируется на активированных Т-клетках) и подавляет связывание и биологическую активность ИЛ-2, назначение даклизумаба подавляет опосредованную ИЛ-2 активацию лимфоцитов - крайне важное звено патогенеза иммунной реакции. что лежит в основе отторжения трансплантата, у рекомендованных дозах Даклизумаб насыщает рецепторную субъединицу Тас на срок около 90 дней, при этом не обнаруживается никаких а /т (антитело), ??которые меняли эффективность, безопасность, сывороточные концентрации даклизумаба или какие-либо другие клинически значимые параметры; выраженных изменений числа циркулирующих лимфоцитов или фенотипов клеток, за исключением вполне ожидаемого транзиторного уменьшения Тас-положительных клеток, не обнаруживается; достоверно снижает частоту подтвержденного гистологически г. (Острый) отторжения почечного аллотрансплантата на протяжении 6 месяцев после пересадки, увеличение частоты отторжения после отмены препарата ("ребаунд-с-м") не отмечалось; выживаемость больных, получавших Даклизумаб, через 6 и 12 месяцев после трансплантации существенно возрастала по сравнению с таковой в группе, получавшей плацебо, при лечении Даклизумаб антилимфоцитарной терапия по поводу г. (Острый) отторжения трансплантата потребовалась меньшему числу больных, чем при введении плацебо.
ПОКАЗАНИЯ: профилактика г. (Острый) отторжения органа у больных, перенесших трансплантацию почки (в составе иммуносупрессивной терапии с циклоспорином и кортикостероидами).
Способ применения и дозы: рекомендуемая доза и детей составляет 1 мг /кг массы тела, р-р в объеме, содержащем нужную дозу, доводится до 50 мл стерильным 0.9% р- ном натрия хлорида и вводится в /в (введение) в течение 15 мин (Минута), первое введение должно осуществляться за 24 ч (Час) к трансплантации, вторая и каждая следующая доза вводятся с интервалами 14 дней, в среднем - 5 доз, время введения последующих доз не должно отклоняться от запланированного более чем на один день в ту или иную сторону; опыт применения у больных пожилого возраста (старше 65 лет) ограничен из-за небольшого количества пересадок, которые были выполнены пациентам этой возрастной группы коррекции дозы у больных с тяжелой почечной недостаточностью не требуется.
Побочное действие при применении ЛС: запоры, тошнота, диарея, рвота, боль в животе, диспепсия, метеоризм, боль в эпигастральной области, тремор, головная боль, головокружение, бессонница олигоурия, дизурия. некроз канальцев почек, боль в грудной клетке, лихорадка, слабость, отеки, повышение или снижение АД (артериальное давление), тахикардия, кровотечения, тромбоз; одышка, отек легких, кашель, плохое заживление ран, акне, боль в костях и мягкие мышцах, боль в поясничном отделе позвоночника; лимфоцеле, нарушения зрения; злокачественные новообразования - через год частота злокачественных новообразований в группе плацебо была 2,7%, в группе даклизумаба - 1,5% (включение даклизумаба в схему терапии не увеличивали число пислятрансплантацийних лимфом; гипергликемия; инфекционная заболеваемость, у детей же частыми побочными эффектами были АГ (артериальная гипертензия), послеоперационная боль, лихорадка, диарея, рвота, зуд.
Противопоказания к применению ЛС: гиперчувствительность к даклизумаба или к любому компоненту препарата.
Формы выпуска ЛС: концентрат для района для инфузий, 25 мг /5 мл во фл.
Визаемодия с другими лекарственными средствамиВзаимодействие не выявлено.
Особенности применения у женщин во время беременности и лактациииБеременность Неизвестно, может иметь повреждающее действие на плод.
Лактация: Сопоставлять индивидуальный риск с потенциальными преимуществами от использования.
Нарушение функции церцево-сосудистой системы: Специальных рекомендаций нет
Нарушение функции печинкы: Специальных рекомендаций нет
Нарушение функции почек Коррекции дозы не требуется.
Нарушение функции дыхательной системы: Специальных рекомендаций нет
дети до 12 лет Специальных рекомендаций нет
Лица пожилого и старческого возраста: Опыт применения ограничен
Информация для врача: Следует иметь наготове все необходимое для лечения реакции гиперчувствительности. Опыт назначения повторного или последующих курсов терапии Даклизумаб посттрансплантационном больным отсутствует. Не предназначен для введения в неразбавленном виде. Перед в /в (введение) введением препарат развести до 50 мл стерильным р-ром 0,9% натрия хлорида. Смешивая р-ны, нельзя зтрушуваты флакон, чтобы не было пены, для растворения его необходимо осторожно переворачивать. Принять меры по обеспечению стерильности приготовленного разведенного района, потому препарат не содержит антимикробных концервантив или бактериостатиков.
После приготовления р-на его нужно ввести не позднее, чем ч /з 4 часа (Час) Если р-н нужно хранить дольше, это следует делать в холодильнике при температуре 2 - 8 ° С не более 24 ч (Время) добавл. Ты к приготовленному района другие препараты или вводить их одновременно ч /з одну инфузионную систему нельзя.
Информация для пациента:
Вспомогательные вещества: полисорбат 80, натрия хлорид, натрия гидрофосфат, натрия дигидрофосфат, хлористоводородная кислота, натрия гидроксид, вода д/и.
5 мл - флаконы (1) - пачки картонные.
5 мл - флаконы (3) - пачки картонные.
ОПИСАНИЕ АКТИВНОГО ВЕЩЕСТВА.
Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.
Иммунодепрессивное средство. Представляет собой гуманизированное моноклональное мышиное антитело. Действует как антагонист рецепторов интерлейкина-2 путем связывания с альфа-цепочкой рецептора интерлейкина-2 на поверхности активированных Т-лимфоцитов.
У больных, перенесших аллогенную пересадку почки при введении даклизумаба в дозе 1 мг/кг через каждые 14 дней (всего 5 инфузий), минимальная концентрация в плазме крови составляет 3.6-11.6 мкг/мл. Для полного насыщения рецепторов интерлейкина 2 необходимы концентрации в плазме от 0.5 до 0.9 мкг/мл, для подавления опосредованной интерлейкином 2 биологической активности - от 5 до 10 мкг/мл. T1/2 у больных с почечным аллотрансплантатом - 270-919 ч (средний - 480 ч), что эквивалентно T1/2 IgG человека. На системный клиренс оказывает влияние масса тела, возраст, пол, расовая принадлежность и наличие протеинурии.
Профилактика острого отторжения после трансплантации почек (в составе комбинированной терапии, включающей циклоспорин и кортикостероиды).
Вводят в/в в течение 15 мин в дозе 1 мг/кг за 24 ч до операции и затем каждые 2 недели после операции. На курс лечения - 5 доз.
Возможны тяжелые аллергические реакции.
Повышенная чувствительность к даклизумабу.
Во время лечения даклизумабом могут потребоваться средства для купирования аллергических реакций.
УСЛОВИЯ И СРОКИ ХРАНЕНИЯ
[MSK]01.04 в РК не зарегистрировано.
Ваша Аптека - Житомир, Житомирская, Город не указан.
Теперь у Вас, как и у остальных жителей Усть-Каменогорска, появилась возможность приобрести лекарств
36,6, Медлюкс - Житомир, Киевская область, Город не указан.
Модуль "Рекламные места" позволит организовать показ рекламных материалов (баннеры, flash
A.MENARINI INDUSTRIE FARMACEUTICHE RIUNITE, S.r.L. - Житомир, Киевская область.
A.MENARINI INDUSTRIE FARMACEUTICHE RIUNITE, S.r.L.
48 ЦНИИ МИНОБОРОНЫ РОССИИ ФГУ - Житомир, Киевская область.
Федеральное Государственное Учреждение 48 Центральный научно-исследовательский институт Министерства
3M ESPE, AG - Житомир, Киевская область, Global.
Компания образована в октябре 2000 г. в результате объединения \\\"3M Dental Products\\\"
ДАКЛИЗУМАБВы можете оформить заявку на выбранную продукцию или услугу. Для этого нажмите на ссылку «Оформить заявку».
При оформлении заявки, указывайте все свои контактные данные.
Вы можете перейти к просмотру всей продукции и услуг этой компании, выбрав ссылку «Продукция и услуги [Продажа] [Показать все]».
36,6, Медлюкс - Житомир, Киевская область, Город не указан.
Модуль "Рекламные места" позволит организовать показ рекламных материалов (баннеры, flash
Ваша Аптека - Житомир, Житомирская, Город не указан.
Теперь у Вас, как и у остальных жителей Усть-Каменогорска, появилась возможность приобрести лекарств
36,6, Медлюкс - Житомир, Киевская область, Город не указан.
Модуль "Рекламные места" позволит организовать показ рекламных материалов (баннеры, flash
(5103 Просмотров с 01-27-2012)
Ваша Аптека - Житомир, Житомирская, Город не указан.
Теперь у Вас, как и у остальных жителей Усть-Каменогорска, появилась возможность приобрести лекарств
(5041 Просмотров с 01-31-2012)
A.MENARINI INDUSTRIE FARMACEUTICHE RIUNITE, S.r.L. - Житомир, Киевская область.
A.MENARINI INDUSTRIE FARMACEUTICHE RIUNITE, S.r.L.
(4302 Просмотров с 01-27-2012)
48 ЦНИИ МИНОБОРОНЫ РОССИИ ФГУ - Житомир, Киевская область.
Федеральное Государственное Учреждение 48 Центральный научно-исследовательский институт Министерства
(4260 Просмотров с 01-27-2012)
3M ESPE, AG - Житомир, Киевская область, Global.
Компания образована в октябре 2000 г. в результате объединения \\\"3M Dental Products\\\"
(4182 Просмотров с 01-27-2012)

27 мая 2016 года FDA одобрило препарат Zinbryta™ (Daclizumab). моноклональное антитело против молекулы CD25 (альфа-субъединица рецептора интерлейкина-2). Производитель лекарства – глобальная американская биотехнологическая компания Biogen Idec.
Показание для применение нового препарата – лечение взрослых пациентов с ремиттирующим рассеянным склерозом (это когда обострения чередуются с ремиссиями; наиболее частая форма заболевания) .
Даклизумаб – старый препарат. Первые данные о нем относятся еще к 1981 году. В 1997 году FDA одобрило его для профилактики отторжения трансплантов почки (тогда у него было другое торговое название). но в 2009 году регистрацию отозвали по инициативе тогдашнего спонсора (компанииRoche) .
Затем права на даклизумаб выкупила AbbVie и начала исследовать его совместно с Biogen Idec у пациентов с рассеянным склерозом. Спонсором исследований выступила Biogen Idec.
FDA приняло свое решение на основании результатов двух исследований, II и III фазы, сравнивших Zinbryta™ против Авонекса® (у 1,841 пациента) и против плацебо (еще 621 пациент) .
Zynbryta™ показана только тем пациентам с РС, кому не помогли одна-две линии стандартных анти-РС препаратов, так как новое моноклональное антитело обладает серьезными побочными эффектами, включая повреждение печени и некоторые иммуногенные состояния.
В связи с этими рисками препарат распространяют под контролем специальной программы RiskEvaluationandMitigationStrategy. Перед тем, как назначить пациенту Zinbryta™ врач обязан выполнить несколько тестов, которые оценят состояние печени пациента. Эти исследования нужно повторять за месяц перед каждым новым введением препарата и в течение 6 месяцев после окончания курса лечения.
Каков механизм действия?
Даклизумаб связывается с альфа-субъединицей рецептора интерлейкина-2 высокой аффинности (СD25) и препятствует его нормальной работе. Это приводит к подавлению пролиферации аутоиммунных лимфоцитов, повышению содержания клеток с регуляторными функциями (включая особую популяцию натуральных киллеров, которые сдерживают активацию аутореактивных клеток). повышению склонность Th17-провоспалительных клеток к апоптозу и другим эффектам, имеющим важное значение в патогенезе рассеянного склероза.

Это акроним названия протокола исследования NCT01064401. включившего 1,841 пациента с ремиттирующим рассеянным склерозом в 244 медицинских центрах в 28 странах с 11 мая 2010 по 16 апреля 2012 года.
В этом исследовании участвовали центры в США, Аргентине, Австралии, Бразилии, Канаде, Чехии, Дании, Финляндии, Франции, Грузии, Германии, Греции, Венгрии, Индии, Ирландии, Израиле, Италии, Мексике, Молдавии, Польше, Румынии, России . Сербии, Испании, Швеции, Швейцарии, Украине и Великобритании.
Коллеги по физибильному цеху, обратите внимание, средний enrollment rate был 0.31pts/site/mo.
В исследование включали пациентов:
Пациентов рандомизировали в соотношении 1:1 в группы:
Лечение продолжалось от 96 до 144 недель. Средняя длительность лечения составила 108.7 недель в группе даклизумаба и 111.4 недель в группе Авонекса®.
Эффективность препарата оценивали по проценту пациентов, у которых в течение каждого года лечения случилось обострение заболевания (annualizedrelapserate). Рецидивов было меньше в группе даклизумаба, чем в группе Авонекса® — 0.22 против 0.39 .

К 144й недели лечения 67% пациентов из группы даклизумаба и 51% пациентов из группы Авонекса® оставались в ремиссии (то есть обострения заболевания не было). Разница была статистически значимой.

Общая частота побочных эффектов была одинаковой в обеих группах. Самые частые побочные эффекты даны в таблице (кликабельно) .

Побочных эффектов со стороны кожи и печени (включая изменения лабораторных показателей, характеризующих работу печени) было больше в группе даклизумаба, чем в группе Авонекса®, в связи с чем и необходимость специальных тестов перед назначением нового лекарства, а также во время и после лечения.

Это было исследование II фазы NCT00390221, сравнившее даклизумаб против плацебо у 621 пациента с ремиттирующим рассеянным склерозом, которых рандомизировали в три группы: 204 на плацебо, 208 на один дозовый уровень и 209 на другой дозовый уровень даклизумаба.
В SELECT участвовали 76 медицинских центров, расположенных в Чехии, Германии, Венгрии, Индии, Польше, России, Украине, Турции и Великобритании. Исследование продолжалось с 15 февраля 2008 года по 14 мая 2010 года.
Препараты и плацебо давали в виде подкожной инъекции один раз в 4 недели, в течение 52 недель
Annualized relapse rate в группах был такой:
То есть, вероятность остаться в ремиссии (в течение года) была выше в группах даклизумаба, чем в группе плацебо – на 54% и 50%, соответственно.
Сколько будет стоит перебрендированный препарат – пока не пишут.
Похожие темы: